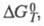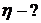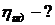Современные реалии предполагают широкую эксплуатацию тепловых двигателей. Многочисленные попытки замены их на электродвигатели пока претерпевают неудачу. Проблемы, связанные с накоплением электроэнергии в автономных системах, решаются с большим трудом.
Все еще актуальны проблемы технологии изготовления аккумуляторов электроэнергии с учетом их длительного использования. Скоростные характеристики электромобилей далеки от таковых у авто на двигателях внутреннего сгорания.
Первые шаги по созданию гибридных двигателей позволяют существенно уменьшить вредные выбросы в мегаполисах, решая экологические проблемы.
Возможность превращения энергии пара в энергию движения была известна еще в древности. 130 год до нашей эры: Философ Герон Александрийский представил на суд зрителей паровую игрушку – эолипил. Сфера, заполненная паром, приходила во вращение под действием исходящих из нее струй. Этот прототип современных паровых турбин в те времена не нашел применения.
Долгие годы и века разработки философа считались лишь забавной игрушкой. В 1629 г. итальянец Д. Бранки создал активную турбину. Пар приводил в движение диск, снабженный лопатками.
С этого момента началось бурное развитие паровых машин.
Превращение внутренней энергии топлива в энергию движения частей машин и механизмов используется в тепловых машинах.
Основные части машин: нагреватель (система получения энергии извне), рабочее тело (совершает полезное действие), холодильник.
Нагреватель предназначен для того, чтобы рабочее тело накопило достаточный запас внутренней энергии для совершения полезной работы. Холодильник отводит излишки энергии.
Основной характеристикой эффективности называют КПД тепловых машин. Эта величина показывает, какая часть затраченной на нагревание энергии расходуется на совершение полезной работы. Чем выше КПД, тем выгоднее работа машины, но эта величина не может превышать 100%.
Пусть нагреватель приобрел извне энергию, равную Q1. Рабочее тело совершило работу A, при этом энергия, отданная холодильнику, составила Q2.
Исходя из определения, рассчитаем величину КПД:
Отсюда КПД тепловой машины, формула которого имеет вид η= (Q1 — Q2)/ Q1 = 1 — Q2/ Q1, позволяет сделать следующие выводы:
- КПД не может превышать 1 (или 100%);
- для максимального увеличения этой величины необходимо либо повышение энергии, полученной от нагревателя, либо уменьшение энергии, отданной холодильнику;
- увеличения энергии нагревателя добиваются изменением качества топлива;
- уменьшения энергии, отданной холодильнику, позволяют добиться конструктивные особенности двигателей.
Возможно ли создание такого двигателя, коэффициент полезного действия которого был бы максимальным (в идеале — равным 100%)? Найти ответ на этот вопрос попытался французский физик-теоретик и талантливый инженер Сади Карно. В 1824 его теоретические выкладки о процессах, протекающих в газах, были обнародованы.
Основной идеей, заложенной в идеальной машине, можно считать проведение обратимых процессов с идеальным газом. Начинаем с расширения газа изотермически при температуре T1. Количество теплоты, необходимой для этого, — Q1. После газ без теплообмена расширяется (процесс адиабатный). Достигнув температуры Т2, газ сжимается изотермически, передавая холодильнику энергию Q2. Возвращение газа в первоначальное состояние производится адиабатно.
КПД идеального теплового двигателя Карно при точном расчете равен отношению разности температур нагревательного и охлаждающего устройств к температуре, которую имеет нагреватель. Выглядит это так: η=(T1 — Т2)/ T1.
Возможный КПД тепловой машины, формула которого имеет вид: η= 1 — Т2/ T1, зависит только от значения температур нагревателя и охладителя и не может быть более 100%.
Более того, это соотношение позволяет доказать, что КПД тепловых машин может быть равен единице только при достижении холодильником абсолютного нуля температур. Как известно, это значение недостижимо.
Теоретические выкладки Карно позволяют определить максимальный КПД тепловой машины любой конструкции.
Доказанная Карно теорема звучит следующий образом. Произвольная тепловая машина ни при каких условиях не способна иметь коэффициент полезного действия больше аналогичного значения КПД идеальной тепловой машины.
Пример 1. Каков КПД идеальной тепловой машины, в случае если температура нагревателя составляет 800 о С, а температура холодильника на 500 о С ниже?
T1= 800 о С= 1073 К, ∆T= 500 о С=500 К, η — ?
Нам не дана температура холодильника, но ∆T= (T1 — Т2), отсюда:
η= ∆T / T1 = 500 К/1073 К = 0,46.
Пример 2. Определите КПД идеальной тепловой машины, если за счет приобретенного одного килоджоуля энергии нагревателя совершается полезная работа 650 Дж. Какова температура нагревателя тепловой машины, если температура охладителя — 400 К?
Q1 = 1 кДж=1000 Дж, А = 650 Дж, Т2 = 400 К, η — ?, T1 = ?
В данной задаче речь идет о тепловой установке, КПД которой можно вычислить по формуле:
Для определения температуры нагревателя воспользуемся формулой КПД идеальной тепловой машины:
Выполнив математические преобразования, получим:
Т1 = 400 К /(1- 650 Дж/ 1000 Дж) = 1142,8 К.
Идеальный тепловой двигатель разработан с учетом идеальных процессов. Работа совершается только в изотермических процессах, ее величина определяется как площадь, ограниченная графиком цикла Карно.
В действительности создать условия для протекания процесса изменения состояния газа без сопровождающих его изменений температуры невозможно. Нет таких материалов, которые исключили бы теплообмен с окружающими предметами. Адиабатный процесс осуществить становится невозможно. В случае теплообмена температура газа обязательно должна меняться.
КПД тепловых машин, созданных в реальных условиях, значительно отличаются от КПД идеальных двигателей. Заметим, что протекание процессов в реальных двигателях происходит настолько быстро, что варьирование внутренней тепловой энергии рабочего вещества в процессе изменения его объема не может быть скомпенсировано притоком количества теплоты от нагревателя и отдачей холодильнику.
Реальные двигатели работают на иных циклах:
- цикл Отто: процесс при неизменном объеме меняется адиабатным, создавая замкнутый цикл;
- цикл Дизеля: изобара, адиабата, изохора, адиабата;
- газовая турбина: процесс, происходящий при постоянном давлении, сменяется адиабатным, замыкает цикл.
Создать равновесные процессы в реальных двигателях (чтобы приблизить их к идеальным) в условиях современной технологии не представляется возможным. КПД тепловых машин значительно ниже, даже с учетом тех же температурных режимов, что и в идеальной тепловой установке.
Но не стоит уменьшать роль расчетной формулы КПД цикла Карно, поскольку именно она становится точкой отсчета в процессе работы над повышением КПД реальных двигателей.
Проводя сравнение идеальных и реальных тепловых двигателей, стоит отметить, что температура холодильника последних не может быть любой. Обычно холодильником считают атмосферу. Принять температуру атмосферы можно только в приближенных расчетах. Опыт показывает, что температура охладителя равна температуре отработанных в двигателях газов, как это происходит в двигателях внутреннего сгорания (сокращенно ДВС).
ДВС – наиболее распространенная в нашем мире тепловая машина. КПД тепловой машины в этом случае зависит от температуры, созданной сгорающим топливом. Существенным отличием ДВС от паровых машин является слияние функций нагревателя и рабочего тела устройства в воздушно-топливной смеси. Сгорая, смесь создает давление на подвижные части двигателя.
Повышения температуры рабочих газов достигают, существенно меняя свойства топлива. К сожалению, неограниченно это делать невозможно. Любой материал, из которого изготовлена камера сгорания двигателя, имеет свою температуру плавления. Теплостойкость таких материалов – основная характеристика двигателя, а также возможность существенно повлиять на КПД.
Если рассмотреть паровую турбину, температура рабочего пара на входе которой равна 800 К, а отработавшего газа — 300 К, то КПД этой машины равно 62%. В действительности же эта величина не превышает 40%. Такое понижение возникает вследствие тепловых потерь при нагревании корпуса турбин.
Наибольшее значение КПД двигателей внутреннего сгорания не превышает 44%. Повышение этого значения – вопрос недалекого будущего. Изменение свойств материалов, топлива – это проблема, над которой работают лучшие умы человечества.
источник
Рабочее тело, получая некоторое количество теплоты Q1от нагревателя, часть этого количества теплоты, по модулю равную |Q2|,отдает холодильнику. Поэтому совершаемая работа не может быть больше A = Q1 — |Q2|.Отношение этой работы к количеству теплоты, полученному расширяющимся газом от нагревателя, называется коэффициентом полезного действия тепловой машины:
Коэффициент полезного действия тепловой машины, работающей по замкнутому циклу, всегда меньше единицы. Задача теплоэнергетики состоит в том, чтобы сделать КПД как можно более высоким, т. е. использовать для получения работы как можно большую часть теплоты, полученной от нагревателя. Впервые наиболее совершенный циклический процесс, состоящий из изотерм и адиабат, был предложен французским физиком и инженером С. Карно в 1824 г.
3) Под идеальной понимается тепловая машина, имеющая максимальный к.п.д. при заданных значениях нагревателя T1 и холодильника T2.
Из второго начала термодинамики следует, что даже у идеального теплового двигателя, работающего без потерь, к.п.д. принципиально ниже 100 % и вычисляется по формуле:
Рабочим телом в идеальной тепловой машине является идеальный газ, а работает она по циклу Карно:
| 1–2 | изотермический | медленно расширяясь при температуре T1, газ получает теплоту Q1 от нагревателя |
| 2–3 | адиабатный | резко расширяясь, газ охлаждается до температуры T2 |
| 3–4 | изотермический | медленно сжимаясь при температуре T2, газ отдает теплоту Q2 холодильнику |
| 4–1 | адиабатный | резко сжимаясь, газ нагревается до температуры T1 |
4)Понятие энтропии впервые было введено Клаузиусом в термодинамике для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
Математически энтропия определяется как функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы:
,
где — приращение энтропии; — минимальная теплота, подведённая к системе; — абсолютная температура процесса.
Энтропия устанавливает связь между макро- и микро- состояниями. Особенность данной характеристики заключается в том, что это единственная функция в физике, которая показывает направленность процессов. Поскольку энтропия является функцией состояния, то она не зависит от того, как осуществлён переход из одного состояния системы в другое, а определяется только начальным и конечным состояниями системы.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Дата добавления: 2015-05-10 ; Просмотров: 617 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Рабочее тело, получая некоторое количество теплоты Q1от нагревателя, часть этого количества теплоты, по модулю равную |Q2|,отдает холодильнику. Поэтому совершаемая работа не может быть больше A = Q1— |Q2|.Отношение этой работы к количеству теплоты, полученному расширяющимся газом от нагревателя, называется коэффициентом полезного действия 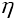
Коэффициент полезного действия тепловой машины, работающей по замкнутому циклу, всегда меньше единицы. Задача теплоэнергетики состоит в том, чтобы сделать КПДкак можно более высоким, т. е. использовать для получения работы как можно большую часть теплоты, полученной от нагревателя. Как этого можно достигнуть?
Впервые наиболее совершенный циклический процесс, состоящий из изотерм и адиабат, был предложен французским физиком и инженером С. Карно в 1824 г.
Допустим, что газ находится в цилиндре, стенки и поршень которого сделаны из теплоизоляционного материала, а дно — из материала с высокой теплопроводностью. Объем, занимаемый газом, равен V1.
Приведем цилиндр в контакт с нагревателем (Рисунок 2) и предоставим газу возможность изотермически расширяться и совершать работу.Газ получает при этом от нагревателя некоторое количество теплоты Q1.Этот процесс графически изображается изотермой (кривая АВ).
Когда объем газа становится равным некоторому значению V1’ V1(изотермаCD). При этом газ отдает холодильнику некоторое количество теплоты Q2,равное совершаемой над ним работе сжатия. После этого газ сжимается адиабатно до объема V1,при этом его температура повышается до Т1(адиабата DA). Теперь газ вернулся в первоначальное состояние, при котором объем его равен V1, температура — T1,давление — p1,и цикл можно повторить вновь.
Итак, на участке ABCгаз совершает работу (А > 0), а на участке CDAработа совершается над газом (А
В реальных двигателях не удается осуществить цикл, состоящий из идеальных изотермических и адиабатных процессов. Поэтому КПД цикла, осуществляемого в реальных двигателях, всегда меньше, чем КПД цикла Карно (при одних и тех же температурах нагревателей и холодильников):
Из формулы видно, что КПД двигателей тем больше, чем выше температура нагревателя и чем ниже температура холодильника.
| Карно Никола Леонар Сади (1796-1832гг.) — талантливый французский инженер и физик, один из основателей термодинамики. В своем труде «Размышление о движущей силе огня и о машинах, способных развивать эту силу» (1824 г.) впервые показал, что тепловые двигатели могут совершать работу лишь в процессе перехода теплоты от горячего тела к холодному. Карно придумал идеальную тепловую машину, вычислил коэффициент полезного действия идеальной машины и доказал, что этот коэффициент является максимально возможным для любого реального теплового двигателя. | 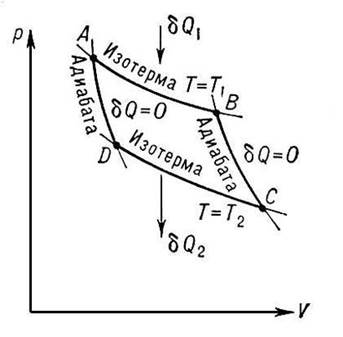 |
Как вспомогательное средство для своих исследований Карно в 1824 году изобрёл (на бумаге) идеальную тепловую машину с идеальным газом в качестве рабочего тела. Важная роль двигателя Карно заключается не только в его возможном практическом применении, но и в том, что он позволяет объяснить принципы действия тепловых машин вообще; не менее важно и то, что Карно с помощью своего двигателя удалось внести существенный вклад в обоснование и осмысление второго начала термодинамики. Все процессы в машине Карно рассматриваются как равновесные (обратимые). Обратимый процесс – это такой процесс, который протекает настолько медленно, что его можно рассматривать как последовательный переход от одного равновесного состояния к другому и т. д., причём весь этот процесс можно провести в обратном направлении без изменения совершённой работы и переданного количества теплоты. (Заметим, что все реальные процессы необратимы) В машине осуществляется круговой процесс или цикл, при котором система после ряда преобразований возвращается в исходное состояние. Цикл Карно состоит из двух изотерм и двух адиабат. Кривые A — B и C — D — это изотермы, а B — C и D — A — адиабаты. Сначала газ расширяется изотермически при температуре T1. При этом он получает от нагревателя количество теплоты Q1. Затем он расширяется адиабатно и не обменивается теплотой с окружающими телами. Далее следует изотермическое сжатие газа при температуре Т2. Газ отдает в этом процессе холодильнику количество теплоты Q2. Наконец газ сжимается адиабатно и возвращается в начальное состояние. При изотермическом расширении газ совершает работу A’1>0, равную количеству теплоты Q1. При адиабатном расширении B — C положительная работа А’3 равна уменьшению внутренней энергии при охлаждении газа от температуры Т1 до температуры Т2: A’3 =-dU1.2=U(T1)-U(Т2). Изотермическое сжатие при температуре Т2 требует совершения над газом работы А2 . Газ совершает соответственно отрицательную работу А’2 = -A2 = Q2. Наконец, адиабатное сжатие требует совершения над газом работы А4 = dU2.1 . Работа самого газа А’4 = -А4 = -dU2.1 = U(T2)-U(Т1). Поэтому суммарная работа газа при двух адиабатных процессах равна нулю. За цикл газ совершает работу А’=A’1+А’2=Q1+Q2=|Q1|-|Q2|. Эта работа численно равна площади фигуры, ограниченной кривой цикла Для вычисления коэффициента полезного действия нужно вычислить работы при изотермических процессах A — B и C — D. Расчеты приводят к следующему результату:  (2) Коэффициент полезного действия тепловой машины Карно равен отношению разности абсолютных температур нагревателя и холодильника к абсолютной температуре нагревателя. Главное значение полученной Карно формулы (2) для КПД идеальной машины состоит в том, что она определяет максимально возможный КПД любой тепловой машины. Карно доказал следующую теорему: любая реальная тепловая машина, работающая с нагревателем температуры Т1 и холодильником температуры Т2, не может иметь коэффициент полезного действия, превышающий КПД идеальной тепловой машины . КПД реальных тепловых машин Формула (2) дает теоретический предел для максимального значения КПД тепловых двигателей. Она показывает, что тепловой двигатель тем эффективнее, чем выше температура нагревателя и ниже температура холодильника. Лишь при температуре холодильника, равной абсолютному нулю, КПД равно 1. В реальных тепловых двигателях процессы протекают настолько быстро, что уменьшение и увеличение внутренней энергии рабочего вещества при изменении его объема не успевает компенсироваться притоком энергии от нагревателя и отдачей энергии холодильнику. Поэтому изотермические про цессы не могут быть реализованы. То же относится и к строго адиабатным процессам, так как в природе нет идеальных теплоизоляторов. Осуществляемые в реальных тепловых двигателях циклы состоят из двух изохор и двух адиабат (в цикле Отто), из двух адиабат, изобары и изохоры (в цикле Дизеля), из двух адиабат и двух изобар (в газовой турбине) и др. При этом следует иметь в виду, что эти циклы могут также быть идеальными, как и цикл Карно. Но для этого необходимо, чтобы температуры нагревателя и холодильника были не постоянными, как в цикле Карно, а менялись бы точно так же, как меняется температура рабочего вещества в процессах изохорного нагрева и охлаждения. Другими словами, рабочее вещество должно контактироваться с бесконечно большим числом нагревателей и холодильников — только в этом случае на изохорах будет равновесная теплопередача. Разумеется, в циклах реальных тепловых двигателей процессы являются неравновесными, вследствие чего КПД реальных тепловых двигателей при одном и том же температурном интервале значительно меньше КПД цикла Карно. Вместе с тем выражение (2) играет огромную роль в термодинамике и является своеобразным «маяком», указывающим пути повышения КПД реальных тепловых двигателей. (2) Коэффициент полезного действия тепловой машины Карно равен отношению разности абсолютных температур нагревателя и холодильника к абсолютной температуре нагревателя. Главное значение полученной Карно формулы (2) для КПД идеальной машины состоит в том, что она определяет максимально возможный КПД любой тепловой машины. Карно доказал следующую теорему: любая реальная тепловая машина, работающая с нагревателем температуры Т1 и холодильником температуры Т2, не может иметь коэффициент полезного действия, превышающий КПД идеальной тепловой машины . КПД реальных тепловых машин Формула (2) дает теоретический предел для максимального значения КПД тепловых двигателей. Она показывает, что тепловой двигатель тем эффективнее, чем выше температура нагревателя и ниже температура холодильника. Лишь при температуре холодильника, равной абсолютному нулю, КПД равно 1. В реальных тепловых двигателях процессы протекают настолько быстро, что уменьшение и увеличение внутренней энергии рабочего вещества при изменении его объема не успевает компенсироваться притоком энергии от нагревателя и отдачей энергии холодильнику. Поэтому изотермические про цессы не могут быть реализованы. То же относится и к строго адиабатным процессам, так как в природе нет идеальных теплоизоляторов. Осуществляемые в реальных тепловых двигателях циклы состоят из двух изохор и двух адиабат (в цикле Отто), из двух адиабат, изобары и изохоры (в цикле Дизеля), из двух адиабат и двух изобар (в газовой турбине) и др. При этом следует иметь в виду, что эти циклы могут также быть идеальными, как и цикл Карно. Но для этого необходимо, чтобы температуры нагревателя и холодильника были не постоянными, как в цикле Карно, а менялись бы точно так же, как меняется температура рабочего вещества в процессах изохорного нагрева и охлаждения. Другими словами, рабочее вещество должно контактироваться с бесконечно большим числом нагревателей и холодильников — только в этом случае на изохорах будет равновесная теплопередача. Разумеется, в циклах реальных тепловых двигателей процессы являются неравновесными, вследствие чего КПД реальных тепловых двигателей при одном и том же температурном интервале значительно меньше КПД цикла Карно. Вместе с тем выражение (2) играет огромную роль в термодинамике и является своеобразным «маяком», указывающим пути повышения КПД реальных тепловых двигателей. | |
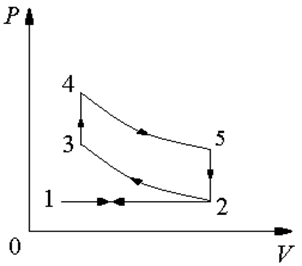 | В цикле Отто сначала происходит всасывание в цилиндр рабочей смеси 1—2, затем адиабатное сжатие 2—3 и после ее изохорного сгорании 3—4, сопровождаемого возрастанием температуры и давления продуктов сгорания, происходит их адиабатное расширение 4—5, затем изохорное падение давления 5—2 и изобарное выталкивание поршнем отработанных газов 2—1. Поскольку на изохорах работа не совершается, а работа при всасывании рабочей смеси и выталкивании отработавших газов равна и противоположна по знаку, то полезная работа за один цикл равна разности работ на адиабатах расширения и сжатия и графически изображается площадью цикла. |
| Сравнивая КПД реального теплового двигателя с КПД цикла Карно, нужно отметить, что в выражении (2) температура Т2 в исключительных случаях может совпадать с температурой окружающей среды, которую мы принимаем за холодильник, в общем же случае она превышает температуру среды. Так, например, в двигателях внутреннего сгорания под Т2 следует понимать температуру отработавших газов, а не температуру среды, в которую производится выхлоп. | |
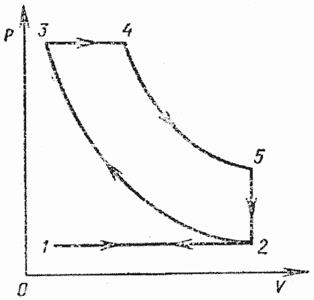 | На рисунке изображен цикл четырехтактного двигателя внутреннего сгорания с изобарным сгоранием (цикл Дизеля). В отличие от предыдущего цикла на участке 1—2 всасывается. атмосферный воздух, который подвергается на участке 2—3 адиабатному сжатию до 3•10 6 —3•10 5 Па. Впрыскиваемое жидкое топливо воспламеняется в среде сильно сжатого, а значит, нагретого воздуха и изобарно сгорает 3—4, а затем происходит адиабатное расширение продуктов сгорании 4—5. Остальные процессы 5—2 и 2—1 протекают так же, как и в предыдущем цикле. Следует помнить, что в двигателях внутреннего сгорания циклы являются условно замкнутыми, так как перед каждым циклом цилиндр заполняется определенной массой рабочего вещества, которая по окончании цикла выбрасывается из цилиндра. |
Но температура холодильника практически не может быть намного ниже температуры окружающего воздуха. Повышать температуру нагревателя можно. Однако любой материал (твердое тело) обладает ограниченной теплостойкостью, или жаропрочностью. При нагревании он постепенно утрачивает свои упругие свойства, а при достаточно высокой температуре плавится. Сейчас основные усилия инженеров направлены на повышение КПД двигателей за счет уменьшения трения их частей, потерь топлива вследствие его неполного сгорания и т. д. Реальные возможности для повышения КПД здесь все еще остаются большими. Так, для паровой турбины начальные и конечные температуры пара примерно таковы: Т1 = 800 К и T2 = 300 К. При этих температурах максимальное значение коэффициента полезного действия равно: 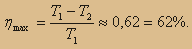 Действительное же значение КПД из-за различного рода энергетических потерь приблизительно равно 40%. Максимальный КПД — около 44% — имеют двигатели внутреннего сгорания. Коэффициент полезного действия любого теплового двигателя не может превышать максимально возможного значения Действительное же значение КПД из-за различного рода энергетических потерь приблизительно равно 40%. Максимальный КПД — около 44% — имеют двигатели внутреннего сгорания. Коэффициент полезного действия любого теплового двигателя не может превышать максимально возможного значения 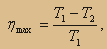 где T1 — абсолютная температура нагревателя, а Т2 — абсолютная температура холодильника. Повышение КПД тепловых двигателей и приближение его к максимально возможному — важнейшая техническая задача. где T1 — абсолютная температура нагревателя, а Т2 — абсолютная температура холодильника. Повышение КПД тепловых двигателей и приближение его к максимально возможному — важнейшая техническая задача. |
Неравенство Клаузиуса
Подведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода (определяется лишь начальным и конечным состояниями системы) — для квазистатических процессов неравенство Клаузиуса обращается в равенство [1] .
Энтропия, функция состояния S термодинамической системы, изменение которой dS для бесконечно малого обратимого изменения состояния системы равно отношению количества теплоты 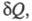
Величина dS является полным дифференциалом, т.е. ее интегрирование по любому произвольно выбранному пути дает разность между значениями энтропии в начальном (А) и конечном (В) состояниях:
Теплота не является функцией состояния, поэтому интеграл от δQ зависит от выбранного пути перехода между состояниями А и В. Энтропия измеряется в Дж/(моль·град).
Понятие энтропии как функции состояния системы постулируется вторым началом термодинамики, которое выражает через энтропию различие между необратимыми и обратимыми процессами. Для первых dS>δQ/T для вторых dS=δQ/T.
Энтропия как функция внутренней энергии U системы, объема V и числа молей ni i-го компонента представляет собой характеристическую функцию (см. Термодинамические потенциалы). Это является следствием первого и второго начал термодинамики и записывается уравнением:
где р — давление, μi — химический потенциал i-го компонента. Производные энтропии по естественным переменным U, V и ni равны:
Простые формулы связывают энтропию с теплоемкостями при постоянном давлении Ср и постоянном объеме Cv:
С помощью энтропии формулируются условия достижения термодинамического равновесия системы при постоянстве ее внутренней энергии, объема и числа молей i-го компонента (изолированная система) и условие устойчивости такого равновесия:
Это означает, что энтропия изолированной системы достигает максимума в состоянии термодинамического равновесия. Самопроизвольные процессы в системе могут протекать только в направлении возрастания энтропии.
Энтропия относится к группе термодинамических функций, называемых функциями Массье-Планка. Другие функции, принадлежащие к этой группе — функция Массье Ф1 = S — (1/T)U и фцнкция Планка Ф2 = S — (1/T)U — (p/T)V, могут быть получены в результате применения к энтропии преобразования Лежандра.
Согласно третьему началу термодинамики (см. Тепловая теорема), изменение энтропии в обратимой химической реакции между веществами в конденсированном состоянии стремится к нулю при T→0:
Постулат Планка (альтернативная формулировка тепловой теоремы) устанавливает, что энтропия любого химического соединения в конденсированном состоянии при абсолютном нуле температуры является условно нулевой и может быть принята за начало отсчета при определении абсолютного значения энтропии вещества при любой температуре. Уравнения (1) и (2) определяют энтропию с точностью до постоянного слагаемого.
В химической термодинамике широко используют следующие понятия: стандартная энтропия S 0 , т.е. энтропия при давлении р=1,01·10 5 Па (1 атм); стандартная энтропия химической реакции 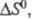
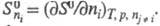
Для расчета химических равновесий применяют формулу:
где К — константа равновесия, 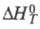
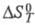
Определение понятия энтропия для неравновесной системы опирается на представление о локальном термодинамическом равновесии. Локальное равновесие подразумевает выполнение уравнения (3) для малых объемов неравновесной в целом системы (см. Термодинамика необратимых процессов). При необратимых процессах в системе может осуществляться производство (возникновение) энтропии. Полный дифференциал энтропии определяется в этом случае неравенством Карно-Клаузиуса:
где dSi > 0 — дифференциал энтропии, не связанный с потоком тепла 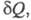
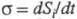
Производство энтропии за счет, например, диффузии компонента i обусловлено силой 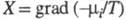
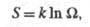
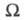
где wi — вероятность i-го состояния.
Абсолютную энтропию химического соединения определяют экспериментально, главным образом калориметрическим методом, исходя из соотношения:
Использование второго начала позволяет определять энтропию химических реакций по экспериментальным данным (метод электродвижущих сил, метод давления пара и др.). Возможен расчет энтропии химических соединений методами статистической термодинамики, исходя из молекулярных постоянных, молекулярной массы, геометрии молекулы, частоты нормальных колебаний. Такой подход успешно осуществляется для идеальных газов. Для конденсированных фаз статистический расчет дает значительно меньшую точность и проводится в ограниченном числе случаев; в последние годы в этой области достигнуты значительные успехи.
Дата добавления: 2016-09-03 ; просмотров: 3380 | Нарушение авторских прав
источник
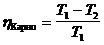
 Рисунок 20 Рисунок 20 | Обратный цикл Qотв = Q2,  = — A = êQ1ï — Q2 = — A = êQ1ï — Q2 |

V.2 Примеры решения задач
ЗАДАЧА V.1 Кислород массой 0,2 кг нагревают от температуры 27° С до 127° С. Найти изменение энтропии, если известно, что начальное и конечное давление газа одинаковы.
Дано: 0,2 кг; 27° С ; 127° С; µ = 0,032 кг/моль.
Энтропия является функцией состояния термодинамической системы, изменение которой в случае обратимого процесса равно приведенной теплоте процесса, т.е.
или в интегральной форме 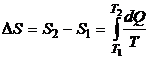
В нашем случае совершается обратимый изобарический процесс, для которого количество тепла при нагревании может быть найдено по формуле

Подставляя 

Используя формулу теплоемкости 

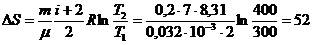
ЗАДАЧА V.2Идеальная холодильная машина работает в интервале температур от 15 до –10 0 С. Работа за один цикл равна 2·10 4 Дж. Вычислить количество теплоты, отданной теплоприемнику за один цикл, и холодильный коэффициент.
Дано: Т1= 15 0 С = 288 К; Т2= -10 0 С = 263 К; А = 2·10 4 Дж.
Идеальная холодильная машина работает по обратному циклу Карно. Расширение происходит при более низкой температуре Т2, чем сжатие Т1. К.п.д. обратного и прямого циклов Карно одинаковы при работе с идеальным газом и равны


Количество теплоты, отданной теплоприемнику за один цикл 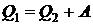

Q2 = 
Q1 = 2,1·10 5 +2·10 4 = 2,3·10 5 Дж.
Холодильная машина за каждый цикл будет передавать более горячему телу 2,3·10 5 Дж, из которых 2,0·10 4 Дж берется за счет превращения работы в теплоту, а остальные 2,1·10 5 Дж переносятся от холодного тела.
Холодильный коэффициент h2равен 
ЗАДАЧА V.3Паровая машина мощность которой14,7 кВт потребляет за 1ч работы 8,1 кг угля с удельной теплотой сгорания 3,3·10 7 Дж/кг. Температура котла 200 0 С, холодильника 58 0 С. Найдите кпд этой машины и сравните его с кпд идеальной тепловой машины.
Дано: m = 8,1 кг; N = 14,7·10 3 Вт; q = 3,3·10 7 Дж/кг; Т1 = 473 К; Т2 = 331 К;
Найти:
Кпд тепловой машины равен отношению производимой механической работы А к затраченному количеству теплоты Q1, выделяющемуся при сгорании угля: 

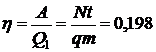


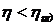
Коэффициент полезного действия идеальной тепловой машины, больше кпд реальной машины.
ЗАДАЧА V.4В ходе обратимого изотермического процесса, протекающего при температуре 350 К, тело совершило работу 80 Дж, а внутренняя энергия тела получила приращение 7,5 Дж. Найти приращение энтропии тела.
Дано: Т = 350 К; А = 80 Дж; 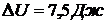
Из первого начала термодинамики вытекает, что в ходе процесса тело получило количество теплоты: 

V.3 Задачи к теме «Второе начало термодинамики. Циклы. Кпд циклов»
406. Некоторый тепловой двигатель на каждые 5 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Сколько тепла он передает холодильнику? Каков КПД этого двигателя?
407Некоторый тепловой двигатель на каждые 20 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Сколько тепла он передает холодильнику? Каков КПД этого двигателя?
408. Некоторый тепловой двигатель на каждые 10 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Сколько тепла он передает холодильнику? Каков КПД этого двигателя?
409.Некоторый тепловой двигатель на каждые 5 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Температура нагревателя 1000°C. Какова максимально возможная температура холодильника?
410. Некоторый тепловой двигатель на каждые 20 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Температура нагревателя 1000°C. Какова максимально возможная температура холодильника?
411. Некоторый тепловой двигатель на каждые 10 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Температура нагревателя 1000°C. Какова максимально возможная температура холодильника?
412. Некоторый тепловой двигатель на каждые 5 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Температура холодильника 25°C. Какова минимально возможная температура нагревателя?
413. Некоторый тепловой двигатель на каждые 20 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Температура холодильника 25°C. Какова минимально возможная температура нагревателя?
414.Некоторый тепловой двигатель на каждые 10 кДж тепла, полученные от нагревателя, производит 3 кДж работы. Температура холодильника 25°C. Какова минимально возможная температура нагревателя?
415. Каков максимально возможный КПД теплового двигателя, работающего при температуре нагревателя 1000°C и температуре холодильника 200°C?
416. Каков максимально возможный КПД теплового двигателя, работающего при температуре нагревателя 1500°C и температуре холодильника 300°C?
417. Каков максимально возможный КПД теплового двигателя, работающего при температуре нагревателя 2000°C и температуре холодильника 500°C?
418. Каков максимально возможный КПД теплового двигателя, работающего при температуре помещения 25°C и температуре окружающей среды –30°C?
419. Каков максимально возможный КПД теплового двигателя, работающего при температуре помещения 20°C и температуре окружающей среды 0°C?
420. Каков максимально возможный КПД теплового двигателя, работающего при температуре помещения 25°C и температуре окружающей среды –10°C?
421. Каков максимально возможный КПД холодильника, работающего при температуре помещения 25°C и температуре морозильного отделения –30°C?
422. Каков максимально возможный КПД холодильника, работающего при температуре помещения 20°C и температуре морозильного отделения -100°C?
423. Найти работу тепловой машины за один цикл, изображенной на рис 14, и КПД цикла.
424. В идеальной тепловой машине количество теплоты, полученное от нагревателя, равно 6,3 кДж. 80% этой теплоты передаётся холодильнику. Найти КПД машины и работу за один цикл.
425. Газ в идеальной тепловой машине получает от нагревателя теплоту 42 кДж. Какую работу совершает газ, если абсолютная температура нагревателя в три раза выше, чем температура холодильника? Сколько тепла газ отдает холодильнику?
426. При совершении цикла Карно газ получил от нагревателя 16,8 кДж энергии и совершил 5,6 кДж работы. Во сколько раз температура нагревателя выше температуры холодильника?
427. Тепловая машина за цикл получает от нагревателя 200 Дж тепла и совершает полезную работу 60 Дж. Определить КПД этой машины.
428. Во сколько раз температура нагревателя больше температуры холодильника, если при цикле Карно с идеальным газом КПД составил 50%?
429. Можно ли передать некоторое количество теплоты веществу, не вызывая этим повышения его температуры? Докажите, что при одной и той же разнице температур между нагревателем и холодильником цикл Карно имеет наибольший КПД по сравнению с любым другим циклом? ?
430. Идеальная тепловая машина с КПД 60% за цикл работы получает от нагревателя 100 Дж. Какую полезную работу машина совершает за цикл?
431. Один киломоль идеального газа совершает цикл, состоящий из двух изохор и двух изобар. При этом объем газа изменяется от 25 м 3 до 50 м 3 , а давление изменяется от 1 атм. до 2 атм. Во сколько раз работа, совершаемая при таком цикле меньше работы, совершаемой при цикле
Карно, изотермы которого соответствуют наибольшей и наименьшей температурам рассматриваемого цикла, если 
432. Один моль газа совершает цикл, состоящий из изохоры, изотермы и изобары (рисунок 21). Определить температуру для характерных точек цикла и работу цикла, если V1 =0,015 м3, p1 =105 Па, p2=3×105 Па.
433. Двухатомный газ совершает цикл Карно, график которого изображен на рисунке 22. В состоянии В объем газа 12 л, давление 20 атм, а в состоянии С объем равен 16 л, давление 5 атм. Найти КПД цикла.
434. Вывести формулу для КПД цикла, состоящего из двух изобар и двух адиабат. Считать, что рабочее вещество является идеальным газом.
435. Газ, совершающий цикл Карно, получает от нагревателя 62 кДж теплоты. Какую работу совершает газ, если абсолютная температура нагревателя в два раза выше, чем температура холодильника?
436. 
437. Идеальный многоатомный газ совершает цикл, изображенный на рисунке 23. Определить термический КПД цикла.
438. Совершая замкнутый цикл, газ получил от нагревателя 9,8 кДж теплоты. Термический КПД цикла равен 0,25. Какую работу совершил газ? Какое количество теплоты газ отдал холодильнику?
439. В сосуде содержится две различные молекулы. Каким числом способов могут быть распределены эти молекулы между левой и правой половинами сосуда? Используя формулу Больцмана, найти энтропию системы в случаях: 1) когда одна из половин сосуда пустая; 2) когда молекулы распределены в сосуде поровну.
440. В сосуде содержится два атома гелия и два атома неона. Каким числом способов могут быть распределены эти атомы между левой и правой половинами сосуда? Используя формулу Больцмана, найти энтропию в трех случаях: а) все атомы соберутся в одной половине; б) в одной находится 3, в другой 1; в) в обеих частях объема находятся по две частицы.
441. Как ведет себя энтропия термодинамической системы при адиабатическом процессе?
442. Азот массой 0,5 кг нагревают изохорически от температуры 27°С до 127°С. Найти изменение энтропии.
443. При температуре 0°С расплавили 1 кг льда. Найти изменение энтропии льда, если теплота плавления льда равна 3,33×10 5 Дж/кг.
444. Один киломоль кислорода расширился изотермически вдвое. Найти изменение энтропии при этом процессе/
445. Смесь водорода массой 0,02 кг и кислорода 0,32 кг нагревают при постоянном давлении от 27°С до 327°С. Найти изменение энтропии смеси.
446. Стальная гиря массой 2 кг вынута из холодильной камеры с температурой -73°С и внесена в помещение с температурой +27°С. Найти изменение энтропии гири, если теплоемкость стали 460 Дж/(кг×К).
447. В чайнике при нормальном давлении выкипел стакан воды (200 г). Найти изменение энтропии этой воды, если скрытая теплота парообразования воды равна 2,26×10 6 Дж/кг.
448. Два киломоля азота расширились изотермически втрое. Найти изменение энтропии при этом процессе.
449. К.п.д. цикла Карно равен 0,3.При изотермическом расширении газ получил от нагревателя 200 Дж энергии. Определить работу, совершаемую при изотермическом сжатии.
450. Современный энергетический блок (паровой котел-турбина-генератор) мощностью 200МВт потребляет в час 75 т угля с удельной теплотой сгорания 25МДж/кг. Температура перегретого пара перед входом в турбину570 0 С, в конденсаторе 30 ºС. Найти фактический к. п. д. энергетического блока и сравнить его к. п. д. цикла Карно, осуществленного между такими же температурами.
451. Газ совершает цикл Карно. Абсолютная температура холодильника 290 К. Во сколько раз увеличится к.п.д., если температура нагревателя повысится от 400 К до 600 К?
452. Вывести формулу для к.п.д. цикла, состоящего из двух изобар и дух адиабат. Считать, что рабочее вещество является идеальным газом
453. Идеальный газ совершает цикл Карно. Температура Т1 нагревателя в три раза выше температуры Т2 охладителя. Нагреватель передал газу количество теплоты Q1=42кДж. Какую работу совершил газ?
454. Идеальный газ, совершающий цикл Карно, получив от нагревателя количество теплоты Q1=804 кДж, совершил работу А=1180 Дж. Найти термический к.п.д. этого цикла. Во сколько раз температура нагревателя больше температуры охладителя?
455. При совершении цикла Карно газ совершил работу 1 кДж и отдал холодильнику 4 кДж теплоты. Во сколько раз температура нагревателя больше температуры холодильника?
457.Газ, совершающий цикл Карно, отдал холодильнику 2/3 полученной от нагревателя теплоты. Определить работу изотермического сжатия газа, совершающего цикл Карно, если температуры нагревателя и холодильника 600К и 300К соответственно и газ получает от нагревателя за цикл 8 кДж теплоты.
458.Идеальная холодильная машина работает по обратному циклу Карно в интервале температур от 100 до 9 0 С. Работа машины за цикл А=-1,55 кДж. Найти: 1) холодильный коэффициент; 2) количество тепла, отводимого от охлаждаемого тепла за цикл. Примечание. Холодильным коэффициентом называют отношение количества тепла, отводимого от охлаждаемого тела, к затраченной работе А =-А.
VI.1 Реальные газы
Для реальных газов необходимо:
-учитывать собственный объем молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объм, в котором могут двигаться молекулы реального газа, будет не Vm, а Vm – b, где b- объем. занимаемый самими молекулами. Объем b равен учетверенному собственному объему молекул;
— учитывать притяжение молекул.Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением.
По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т.е. 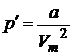
Дата добавления: 2018-04-15 ; просмотров: 440 ; ЗАКАЗАТЬ РАБОТУ
источник
Рабочее тело, получая некоторое количество теплоты Q1от нагревателя, часть этого количества теплоты, по модулю равную |Q2|,отдает холодильнику. Поэтому совершаемая работа не может быть больше A = Q1 — |Q2|.Отношение этой работы к количеству теплоты, полученному расширяющимся газом от нагревателя, называется коэффициентом полезного действия тепловой машины:
Коэффициент полезного действия тепловой машины, работающей по замкнутому циклу, всегда меньше единицы. Задача теплоэнергетики состоит в том, чтобы сделать КПД как можно более высоким, т. е. использовать для получения работы как можно большую часть теплоты, полученной от нагревателя. Впервые наиболее совершенный циклический процесс, состоящий из изотерм и адиабат, был предложен французским физиком и инженером С. Карно в 1824 г.
3) Под идеальной понимается тепловая машина, имеющая максимальный к.п.д. при заданных значениях нагревателя T1 и холодильника T2.
Из второго начала термодинамики следует, что даже у идеального теплового двигателя, работающего без потерь, к.п.д. принципиально ниже 100 % и вычисляется по формуле:
Рабочим телом в идеальной тепловой машине является идеальный газ, а работает она по циклу Карно:
| 1–2 | изотермический | медленно расширяясь при температуре T1, газ получает теплоту Q1 от нагревателя |
| 2–3 | адиабатный | резко расширяясь, газ охлаждается до температуры T2 |
| 3–4 | изотермический | медленно сжимаясь при температуре T2, газ отдает теплоту Q2 холодильнику |
| 4–1 | адиабатный | резко сжимаясь, газ нагревается до температуры T1 |
4)Понятие энтропии впервые было введено Клаузиусом в термодинамике для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
Математически энтропия определяется как функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы:
,
где — приращение энтропии; — минимальная теплота, подведённая к системе; — абсолютная температура процесса.
Энтропия устанавливает связь между макро- и микро- состояниями. Особенность данной характеристики заключается в том, что это единственная функция в физике, которая показывает направленность процессов. Поскольку энтропия является функцией состояния, то она не зависит от того, как осуществлён переход из одного состояния системы в другое, а определяется только начальным и конечным состояниями системы.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Дата добавления: 2015-05-10 ; Просмотров: 618 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
«Физика — 10 класс»
Что такое термодинамическая система и какими параметрами характеризуется её состояние.
Сформулируйте первый и второй законы термодинамики.
Именно создание теории тепловых двигателей и привело к формулированию второго закона термодинамики.
Запасы внутренней энергии в земной коре и океанах можно считать практически неограниченными. Но для решения практических задач располагать запасами энергии ещё недостаточно. Необходимо так же уметь за счёт энергии приводить в движение станки на фабриках и заводах, средства транспорта, тракторы и другие машины, вращать роторы генераторов электрического тока и т. д. Человечеству нужны двигатели — устройства, способные совершать работу. Большая часть двигателей на Земле — это тепловые двигатели.
Тепловые двигатели — это устройства, превращающие внутреннюю энергию топлива в механическую работу.
Принцип действия тепловых двигателей.
Для того чтобы двигатель совершал работу, необходима разность давлений по обе стороны поршня двигателя или лопастей турбины. Во всех тепловых двигателях эта разность давлений достигается за счёт повышения температуры рабочего тела (газа) на сотни или тысячи градусов по сравнению с температурой окружающей среды. Такое повышение температуры происходит при сгорании топлива.
Одна из основных частей двигателя — сосуд, наполненный газом, с подвижным поршнем. Рабочим телом у всех тепловых двигателей является газ, который совершает работу при расширении. Обозначим начальную температуру рабочего тела (газа) через T1. Эту температуру в паровых турбинах или машинах приобретает пар в паровом котле. В двигателях внутреннего сгорания и газовых турбинах повышение температуры происходит при сгорании топлива внутри самого двигателя. Температуру Т1 называют температурой нагревателя.
Роль холодильника.
По мере совершения работы газ теряет энергию и неизбежно охлаждается до некоторой температуры Т2, которая обычно несколько выше температуры окружающей среды. Её называют температурой холодильника. Холодильником является атмосфера или специальные устройства для охлаждения и конденсации отработанного пара — конденсаторы. В последнем случае температура холодильника может быть немного ниже температуры окружающего воздуха.
Таким образом, в двигателе рабочее тело при расширении не может отдать всю свою внутреннюю энергию на совершение работы. Часть тепла неизбежно передаётся холодильнику (атмосфере) вместе с отработанным паром или выхлопными газами двигателей внутреннего сгорания и газовых турбин.
Эта часть внутренней энергии топлива теряется. Тепловой двигатель совершает работу за счёт внутренней энергии рабочего тела. Причём в этом процессе происходит передача теплоты от более горячих тел (нагревателя) к более холодным (холодильнику). Принципиальная схема теплового двигателя изображена на рисунке 13.13.
Рабочее тело двигателя получает от нагревателя при сгорании топлива количество теплоты Q1, совершает работу А’ и передаёт холодильнику количество теплоты Q2
Так как у всех двигателей некоторое количество теплоты передаётся холодильнику, то η
Карно придумал идеальную тепловую машину с идеальным газом в качестве рабочего тела. Идеальная тепловая машина Карно работает по циклу, состоящему из двух изотерм и двух адиабат, причем эти процессы считаются обратимыми (рис. 13.14). Сначала сосуд с газом приводят в контакт с нагревателем, газ изотермически расширяется, совершая положительную работу, при температуре Т1, при этом он получает количество теплоты Q1.
Затем сосуд теплоизолируют, газ продолжает расширяться уже адиабатно, при этом его температура понижается до температуры холодильника Т2. После этого газ приводят в контакт с холодильником, при изотермическом сжатии он отдаёт холодильнику количество теплоты Q2, сжимаясь до объёма V4
Как следует из формулы (13.17), КПД машины Карно прямо пропорционален разности абсолютных температур нагревателя и холодильника.
Главное значение этой формулы состоит в том, что в ней указан путь увеличения КПД, для этого надо повышать температуру нагревателя или понижать температуру холодильника.
Любая реальная тепловая машина, работающая с нагревателем, имеющим температуру Т1, и холодильником с температурой Т2, не может иметь КПД, превышающий КПД идеальной тепловой машины: Процессы, из которых состоит цикл реальной тепловой машины, не являются обратимыми.
Формула (13.17) даёт теоретический предел для максимального значения КПД тепловых двигателей. Она показывает, что тепловой двигатель тем эффективнее, чем больше разность температур нагревателя и холодильника.
Лишь при температуре холодильника, равной абсолютному нулю, η = 1. Кроме этого доказано, что КПД, рассчитанный по формуле (13.17), не зависит от рабочего вещества.
Но температура холодильника, роль которого обычно играет атмосфера, практически не может быть ниже температуры окружающего воздуха. Повышать температуру нагревателя можно. Однако любой материал (твёрдое тело) обладает ограниченной теплостойкостью, или жаропрочностью. При нагревании он постепенно утрачивает свои упругие свойства, а при достаточно высокой температуре плавится.
Сейчас основные усилия инженеров направлены на повышение КПД двигателей за счёт уменьшения трения их частей, потерь топлива вследствие его неполного сгорания и т. д.
Для паровой турбины начальные и конечные температуры пара примерно таковы: Т1 — 800 К и Т2 — 300 К. При этих температурах максимальное значение коэффициента полезного действия равно 62 % (отметим, что обычно КПД измеряют в процентах). Действительное же значение КПД из-за различного рода энергетических потерь приблизительно равно 40 %. Максимальный КПД — около 44% — имеют двигатели Дизеля.
Охрана окружающей среды.
Трудно представить современный мир без тепловых двигателей. Именно они обеспечивают нам комфортную жизнь. Тепловые двигатели приводят в движение транспорт. Около 80 % электроэнергии, несмотря на наличие атомных станций, вырабатывается с помощью тепловых двигателей.
Однако при работе тепловых двигателей происходит неизбежное загрязнение окружающей среды. В этом заключается противоречие: с одной стороны, человечеству с каждым годом необходимо всё больше энергии, основная часть которой получается за счёт сгорания топлива, с другой стороны, процессы сгорания неизбежно сопровождаются загрязнением окружающей среды.
При сгорании топлива происходит уменьшение содержания кислорода в атмосфере. Кроме этого, сами продукты сгорания образуют химические соединения, вредные для живых организмов. Загрязнение происходит не только на земле, но и в воздухе, так как любой полёт самолёта сопровождается выбросами вредных примесей в атмосферу.
Одним из следствий работы двигателей является образование углекислого газа, который поглощает инфракрасное излучение поверхности Земли, что приводит к повышению температуры атмосферы. Это так называемый парниковый эффект. Измерения показывают, что температура атмосферы за год повышается на 0,05 °С. Такое непрерывное повышение температуры может вызвать таяние льдов, что, в свою очередь, приведёт к изменению уровня воды в океанах, т. е. к затоплению материков.
Отметим ещё один отрицательный момент при использовании тепловых двигателей. Так, иногда для охлаждения двигателей используется вода из рек и озёр. Нагретая вода затем возвращается обратно. Рост температуры в водоёмах нарушает природное равновесие, это явление называют тепловым загрязнением.
Для охраны окружающей среды широко используются различные очистительные фильтры, препятствующие выбросу в атмосферу вредных веществ, совершенствуются конструкции двигателей. Идёт непрерывное усовершенствование топлива, дающего при сгорании меньше вредных веществ, а также технологии его сжигания. Активно разрабатываются альтернативные источники энергии, использующие ветер, солнечное излучение, энергию ядра. Уже выпускаются электромобили и автомобили, работающие на солнечной энергии.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основы термодинамики. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
источник
- http://studopedia.su/16_74369_koeffitsient-poleznogo-deystviya-teplovoy-mashini.html
- http://lektsii.org/6-73704.html
- http://studopedia.net/4_40350_koeffitsient-poleznogo-deystviya-idealnoy-mashini-karno.html
- http://studopedia.su/16_74369_koeffitsient-poleznogo-deystviya-teplovoy-mashini.html
- http://class-fizika.ru/10_a189.html