Свойства и характеристики любого вещества определяются его химическим составом. В современных лабораториях проводятся химические экспертизы, позволяющие определить качественный и количественный состав практически любого объекта, например, почвы или пищевого продукта.
Химическая связь, строение и свойства вещества
Взаимодействия, результатом которых становится объединение химических частиц в вещества, принято делить на химические и межмолекулярные связи. Первая группа, в свою очередь, подразделяется на ионную, ковалентную и металлическую связи.
Ионная связь представляет собой связь разноименно заряженных ионов. Такая связь возникает за счет электростатического притяжения. Для того чтобы ионная связь образовалась, ионы должны быть разного размера. Это обусловлено тем, что ионы определенного размера склонны отдавать электроны, а другие – принимать их.
Ковалентная связь возникает за счет образования общей пары электронов. Для ее возникновения необходимо, чтобы радиус атомов был одинаковым или схожим.
Металлическая связь возникает за счет обобществления валентных электронов. Она образуется в случае, если размер атомов большой. Такие атомы обычно отдают электроны.
По типу строения все вещества можно разделить на молекулярные и немолекулярные. Большинство органических веществ относится к первому типу. По типу химической связи различают вещества с ковалентными, ионными и металлическими связями.
Основные положения теории химического строения органических веществ
Теория Бутлерова – научный фундамент всей органической химии. Опираясь на ее основные положения, Бутлеров дал объяснение изомерии, что впоследствии помогло ему открыть несколько изомеров.
Согласно теории химического строения органических веществ, соединение атомов в молекулах строго упорядочено. Оно происходит в определенной последовательности (в зависимости от валентности атомов). Последовательность межатомных связей принято называть химическим строением молекулы.
Другим важным положением этой теории является возможность использования различных химических методов для определения строения вещества.
Группы атомов в молекуле взаимосвязаны и оказывают воздействие друг на друга. Основные свойства вещества, согласно данной теории, определяются его химическим строением.
Химическое строение органических веществ
Как известно, в составе органических веществ всегда присутствует углерод. Этим органические вещества отличаются от неорганических. Органические вещества используются в быту, они служат сырьевой базой для производства продуктов питания и различных продовольственных товаров.
Ученым удалось синтезировать множество видов органических веществ, которых нет в природе (различные виды пластмасс, каучук и другие). Органические вещества отличаются от неорганических своим химическим строением. Атомы углерода образуют различные цепи и кольца. Этим объясняется огромное разнообразие органических веществ в природе.
Атомные связи в таких веществах имеют ярко выраженный ковалентный характер. При нагревании органические вещества полностью разлагаются. Это объясняется небольшой прочностью межатомных связей.
Среди органических соединений широко распространено такое явление, как изомерия.
Исследование химического вещества
Исследование химических веществ, как правило, проводится в специальных лабораториях и экспертных центрах. Это позволяет определить точный количественный и качественный состав исследуемого материала.
Если химический состав вещества полностью неизвестен, сотрудники лаборатории применяют целый комплекс аналитических методов. Специалисты выявляют точное содержание в образцах вещества тех или иных химических элементов.
Проведение исследования химического состава вещества происходит поэтапно:
- сначала специалисты определяют цели своей работы;
- затем, проводят классификацию образцов вещества;
- далее, идет количественный и качественный анализ.
Часто в лабораторных условиях различные вещества проверяются на содержание токсичных элементов и промышленных материалов.
Химические реакции
Химические реакции – это превращения одних веществ (исходных реагентов) в другие. При этом происходит перераспределение электронов. В отличие от ядерных реакций, химические реакции не влияют на общее количество ядер атомов и не изменяют изотопный состав химических элементов.
Условия протекания химических реакций могут быть различными. Они могут проходить при физическом контакте реагентов, их смешивании, нагревании, а также при воздействии света, электрического тока, ионизирующего излучения. Часто химические реакции протекают под влиянием катализаторов.
Скорость химической реакции зависит от концентрации активных частиц во взаимодействующих веществах и от разницы между энергией связи, которая разрывается, и той энергией, которая образуется.
В результате химических процессов образуются новые вещества, свойства которых отличны от свойств исходных реагентов. Однако во время химических реакций не происходит образования атомов новых элементов.
Российский регистр химических и биологических веществ
Российский регистр потенциально опасных химических и биологических веществ занимается проведением независимых экспертиз различной продукции с целью установить ее соответствие санитарно-эпидемиологическим и гигиеническим требованиям.
Это учреждение проводит маркировку химических веществ в соответствии с общепризнанной классификацией. Задачей регистра является информационное обеспечение в сфере химической безопасности, а также содействие интеграции нашей страны в мировое экономическое сообщество.
Российский регистр ежегодно публикует списки химических веществ, представляющие угрозу для жизни людей, данные об их транспортировке, утилизации, токсичности и других параметрах.
В открытом доступе можно найти списки химических веществ, прошедших государственную регистрацию, базу данных опасных веществ.
Федеральный регистр является главным информационным ресурсом, который обеспечивает реализацию многих международных договоров, которые заключила наша страна в отношении опасных химических веществ и пестицидов.
Производители и поставщики химических веществ для промышленных предприятий
Химические вещества для различных отраслей производства изготавливаются на крупных комбинатах и заводах. Лидером среди производителей подобной продукции является компания «РУСХИМТЕХ». Она специализируется на разработке инноваций в области органической химии.
Другим предприятием, которое специализируется на производстве химических веществ, является компания «Сарсилика». Предприятие производит диоксид кремния для заводов.
Среди крупных поставщиков химического сырья можно отметить фирму “БИО-ХИМ”. Компания занимается поставками различных химических веществ на отечественные заводы и фабрики.
Производство, получение химических веществ и химических продуктов
Производство химических веществ дает возможность получать синтетические материалы, способные заменить природные. В свое время такая необходимость была продиктована нехваткой природных материалов или их стоимостью, поэтому человечеству пришлось изобрести синтетические заменители.
С помощью химических реакций можно значительно быстрее получить некоторые природные вещества, которые естественным путем образовываются очень долго. Кроме экономии природного сырья, химическое производство позволяет улучшить физико-механические характеристики и химические свойства полученных материалов.
Для получения многих химических веществ используются такие химические реакции, как катализ, гидролиз, электролиз, химический распад и другие.
Химические свойства используются:
- в металлургии;
- в производстве полиэтиленов, пластмасс;
- для получения азотных и фосфорных удобрений, лекарственных препаратов и других полезных материалов практически в любой области производства и сфере деятельности человека.
Оборудование для получения химических веществ
Учитывая многопрофильность химического производства, оборудование для разных видов продукции значительно отличается. Но в общем случае на производстве задействованы нагревательные элементы, специальные, устойчивые к высоким температурам и агрессивным средам емкости, смесители. Любая переработка происходит на принципах химических реакций (например, обработка химических волокон, нанесение защитных слоев на стекло или металл).
Использование химических веществ
Химические вещества применяются очень широко в связи с тем, что синтетические заменители сейчас существуют практически во всех областях промышленности.
Химические вещества:
- являются сырьем для производства пищевых продуктов;
- служат основой для создания сельскохозяйственных удобрений;
- используются в лакокрасочном производстве, в металлообработке;
- необходимы для стеклопроизводства.
Химические вещества в промышленности
В промышленности используются два типа химических веществ: органические и неорганические.
К первым относятся производные природной нефти и газа, ко вторым:
- слабые и сильные кислоты;
- щелочи;
- цианиды;
- сернистые соединения;
- тяжелые жидкости (типа бромоформа).
Производители и поставщики химических веществ для производств
Наиболее крупными представителями производства и поставок сырья для химического производства в России являются компании:
- «Сибур Холдинг» (Москва) – нефтехимический холдинг;
- «Салаватнефтеоргсинтез» (Салават, Башкортостан) – комбинат, имеющий в свое составе химический, нефтехимический, нефтеперерабатывающий заводы, завод нефтехимических производств, заводы «Синтез», «Мономер», завод минеральных удобрений;
- «Нижнекамскнефтехим» (Нижнекамск, Татарстан) — нефтехимическая компания;
- «Еврохим» (Москва) – удобрения, кормовые фосфаты, минеральное сырье и промышленные продукты;
- «Уралкалий» (Березники, Пермский край) – мировой лидер по производству калия.,
- «Акрон» (Великий Новгород) – минеральные удобрения.
Химические вещества в продуктах питания
В химических продуктах часть химических добавок является непреднамеренными. Это остаточные явления после удобрения полей, на которых выращивались овощи или фрукты, остатки препаратов, которыми лечили животных, вещества, выделяемые из пластиковых упаковочных материалов.
К преднамеренным химикатам в продуктах относят консерванты неприродного происхождения для более длительного хранения продуктов.
Техника безопасности при работе с химическими веществами
К опасным химическим веществам относятся такие, которые при непосредственном контакте наносят вред здоровью человека, провоцирую производственные травмы и заболевания. Последние могут проявляться как сразу после воздействия, так и позже, влиять на продолжительность жизни человека и его детей.
При работе с ядовитыми газами, ядовитыми, токсичными, радиоактивными, легковоспламеняющимися веществами, в условиях повышенного уровня пыли руководство обязано обеспечить условия по минимизации вредного воздействия. Сотрудники подобных предприятий имеют льготы по продолжительности рабочего дня, прибавку к отпуску и зарплате, раньше выходят на пенсию. Кроме того, они обязаны регулярно проходить профильное медицинское обследование, а непосредственно на рабочем месте строго соблюдать осторожность и правила техники безопасности.
Промышленные аварии с выбросом опасных химических веществ
Аварии на химических производствах обычно сопровождаются разливом или выбросом опасных химических веществ. Это приводит к гибели или химическому заражению людей, продовольствия, пищевого сырья и кормов, сельскохозяйственных животных и растений или к загрязнению окружающей природной среды.
Виды аварий с выбросом химически опасных веществ:
- аварии с выбросом (угрозой выброса) химически опасных веществ (ХОВ) при их производстве, переработке или хранении (захоронении);
- аварии на транспорте с выбросом (угрозой выброса) ХОВ;
- образование и распространение ХОВ в процессе химических реакций;
- аварии с химическими боеприпасами.
Основным показателем степени опасности химически опасных объектов считают численность населения, проживающего в зоне возможного химического заражения в случае аварии. Подобные аварии могут происходить непосредственно на заводах по переработке или производству ХОВ, на нефтеперерабатывающих предприятиях, при их транспортировке, на складах хранения ХОВ.
Современные предприятия химической области постоянно внедряют новые технологии производств, направленные на минимизацию возможности возникновения аварий с выбросом опасных химических веществ.
Занимательная химия
Химические реакции
Выращивание кристаллов
Простые вещества
Сложные вещества
Занимательная химия — естественная наука, которая на описательных примерах, не углубляясь в «дебри» формул и теории, показывает и рассказывает о строении и превращении простых и сложных веществ.
Занимательная химия повествует о наиболее интересных и полезных свойствах, используемых веществ. Иллюстрации и фотографии, представленные на сайте, позволяют увидеть и ознакомиться с некоторыми часто употребляемыми химическими соединениями (например, веществами, содержащими кальций и натрий).
Занимательная химия в доступной форме даст представление о чистых металлах, их сплавах, сложных и простых химических веществах, высокомолекулярных соединениях, с которыми Вы часто имеете дело, например, у себя в квартире.
Всем знакомая марганцовка (некоторые называют её «марганцем») — тоже сложное вещество и имеет свои выраженные свойства. К этому же классу веществ относится используемая нами на куне пищевая сода, в ванной — стиральная сода.
В природе большинство веществ является сложными, то есть, образованными в процессе химических реакций соединения из простых веществ. Именно сложными веществами, в основном, представлено разнообразие используемых веществ на нашей платнете!
Простые вещества или сложные вещества имеют индивидуально выраженные свойства, которые в свою очередь разделяются на химические и физические. Мы пользуемся ими, особо не задумываясь об этом, используя свойства выбранной нами системы в корыстных целях. Например, питаемся именно той пищей, которая нам нравится, т.к. она имеет определённый, приемлемый для нас вкус, сладкий — выраженный наличием сахарозы и глюкозы, кислый — выраженный различными органическими кислотами, солёный – наличием соли, горький – также наличием соли или химическим соединением другого класса. Химические свойства проявляются в химических реакциях. Питаясь, мы подвергаем пищу химическим реакциям, благодаря которым и чувствуем её вкус. Реакции, происходящие у нас на языке, также относятся к химическим. Кроме того, отдельные области языка воспринимают определённый вкус: кончик – сладкий, боковые части – солёный и кислый, ближе к основанию – горький. Слюна содержит 90% воды, остальные – минеральные соли, имеющие слабощелочную реакцию.
Вся химия базируется на 2-х «китах»: органическая химия и неорганическая химия. У них много общего, но и много различий. Общее заключено в единых законах превращений и взаимодействий между веществами (например, такая органическая кислота, как уксусная и такая неорганическая кислота, как соляная, будут иметь сходные химические свойства, — растворять некоторые металлы, реагировать с солями, основными оксидами, щелочами и основаниями). Различия конечно же есть и заключены в химическом строении каждой из них.
База знаний по неорганической химии заключена в следующих классах: кислоты, щелочи и основания, оксиды, металлы и неметаллы.
Знание основных свойств главных предствителей каждого класса позволит легко ориентироваться в химии! На данном сайте Занимательная химия вы найдёте все основные свойства классов химических веществ, представленные в описательной форме. Свойства иллюстрированы рисунками и пояснениями, занимательными фактами и описаниями.
Химия Земли. Из каких элементов состоит наша Планета
Можно с уверенностью сказать, что Земля состоит из всех элементов, которые имеет таблица Менделеева, но каждый элемент составляет свою массовую долю нашей планеты. Кислород O2 — основной и, можно сказать, один из основных элементов Земли. Его процентное содержание по массе Земли составляет около 49,5%.
Следующим элементом по массе является кремний — Si. Его массовая доля составляет 25,3%. На третем месте — алюминий — Al. Он составляет 7,5% от массы Земли. Далее идёт железо — 5,1%, кальций — Са -3,4%, натрий — 2,6% калий — 2,4%, магний -1,9, водород — 1,0%, титан — 0,6%, углерод — 0,1%. Остальные металлы и неметаллы составляют менее 0,1% от массы Земли.
Химия атмосферы. Из каких газов состоит атмосфера
Наша атмосфера — оболочка, состоящая из нескольких основных слоёв, общая толщина которых превыщает 1000 км. Между слоями не существут чётких границ. В порядке удаления от поверхности Земли в состав атмосферы входят: тропосфера (около 11. 12 км), стратосфера (до 45. 50 км), мезосфера (до 85. 95 км), термосфера (до 600. 700 км), экзосфера (выше 800 км). С увеличением высоты падает давление находящихся в атмосфере газов (увеличивается разряжение). Основная часть воздуха, конечно же, сосредоточена в ближних слоях атмосферы. Сухой воздух является смесью газов и имеет ледующую пропорцию по объёму: азот (78,095%), кислород (20,939%), углекислый газ (0,031%), инертные газы (гелий, неон, криптон, ксенон, аргон — 0,935%), из которых аргон составляет 0,933%.
Химия человека. Из каких элементов состоит наше тело
Как вы думаете, насколько богат человеческий организм различными химическими элементами?! Оказывается 4 % от веса человека – это минеральные вещества и микроэлементы, что составляет 81 химический элемент таблицы Менделеева. Эти микроэлементы попадают в наш организм с пищей и разносятся транспортными белками в зоны активного обмена веществ или накапливаются в нашем организме. Человек нуждается в микроэлементах, они используются в синтезе полезных органических веществ и их взаимном обмене. Отсутствие любого из 81 микроэлемента может вызвать серьёзные проблемы со здоровьем. Но, конечно, и избыток их не менее вреден!
Рассмотрим на примере действие такого химического элемента, как бром. Бром – известный всем галоген (подробнее о нём можно прочитать на страничке неметаллы). Так вот, в малых количествах этот элемент полезен для организма. Он отвечает за процессы в коре головного мозга: возбуждение и торможение, используется в качестве успокоительного средства в аптечных препаратах, предотвращает появление плесневых грибков в продуктах питания (например, в хлебе). Человек получает его в основном из морских продуктов. С другой стороны, бром очень плохо выводится и накапливается в организме человека. Вот тогда-то и проявляются все его самые негативные свойства на организм: сыпь, ухудшение сна, потеря координации движения, нервные расстройства. Про переизбыток брома, можно особо не переживать, так как, в основном это случается с людьми, которые принимают лекарственные препарату, содержащие бром (особенно, если не по назначению!).
Воздух – это среда, через которую в наш организм попадают тяжёлые металлы. К ним относятся кадмий, свинец и др. Все, наверное, замечали, разницу в воздухе возле городских автодорог и где-нибудь в парках. Растения, фрукты, растущие возле автодорог, железнодорожных вокзалов, впитывают в себя с воздухом эти металлы и могут принести вред для человека при их употреблении. Вот, например, свинец блокирует полезное влияние цинка на организм, нарушая иммунитет, здоровье кожи, работу пищеварительных органов.
С воздухом также в наш организм попадают и микроэлементы, содержащиеся в аэрозолях, например, алюминий: его избыто блокирует положительный эффект от микроэлемента магния, отвечающего за здоровье и работу сердца и сосудов! Поэтому, принимая препараты микроэлементы, нужно сохранять их баланс в организме. Тогда они будут приносить положительный эффект!
Ну и конечно же, вода! Она составляет более 80% веса организма человека. Потребность человека в воде — постоянна! Существует норма приема воды для нормального функционирования всех органов и поддержания здоровья человека. Нормы приёма воды
Почему химия в еде и пищевые добавки не должны пугать людей
«Химическая еда» — страшилка нашего времени. Люди не хотят питаться вредной химией, а хотят есть полезные натуральные продукты. Но то, что они под этим понимают, по большей части мифы, рассказывает химик-флейворист Сергей Белков.
Применительно к еде химия сегодня употребляется как ругательство. Но ведь химия — это фундаментальное свойство нашего мира, из химических веществ состоит все на свете, включая самого человека. И еда не исключение.
Мифы о химии в продуктах
Первый миф состоит в том, что может быть еда без химии. Не может. Химии в еде — 100%. Другой вопрос в том, взяты ли эти химические вещества в продуктах питания из природы или синтезированы человеком.
Второй миф — все натуральное полезно, а искусственное вредно. На самом деле натуральное отличается только тем, что оно встречается в природе, и только этим. Натуральное – не есть полезное. Вот пример: лесные пожары — это натуральное явление, такое же как и смерть от оспы, а паровое отопление — искусственное явление. И что из этого полезно, а что вредно?
Еще один миф состоит в том, что всякого рода искусственные добавки к пище — это изобретение недавнего времени. Первый в мире искусственный ароматизатор придумал человек, который стал жарить мясо, потому что запаха жареного мяса не существует в природе.
Запах и вкус жареного мяса — это результат взаимодействия веществ, которые существуют в сыром мясе, при его нагревании. Причем химического взаимодействия. Запах и вкус сыра тоже искусственный, так как в природе не существует сыра. Но человек научился изготавливать этот продукт довольно давно, причем целью создания было вовсе не улучшение вкуса, а желание законсервировать химические вещества молока.
Многие растительные вещества, которые мы склонны считать полезными потому лишь, что они натуральные, на самом деле являются химическим оружием растений.
Они отобраны эволюцией с целью нанесения максимального вреда любому, кто захочет съесть растение. Многие являются ядами. Например, кофеин в растении выполняет роль инсектицида: защищает его от насекомых. Вообще кофе можно смело считать смесью инсектицидов и ароматизаторов, ведь и аромат кофе, по сути, искусственный. Зеленый кофе не пахнет, а «натуральный» запах кофе есть результат искусственных химических реакций, происходящих в зернах при нагревании.
А что такое, например, ванилин, который мы добавляем во всевозможные кондитерские продукты как натуральный ароматизатор? С химической точки зрения ванилин является ароматическим фенолом и ароматическим альдегидом одновременно. Я бы не хотел есть такое.
В знаменитых ванильных стручках ванилина от природы нет, он появляется в них только после созревания и опадения. Ванилин не нужен растению, его цель — защита семян от вредных плесеней и бактерий. Это вещество, защищающее растения от поедания, и лишь волей случая его вкус понравился человеку, что не говорит о его полезности.
То же и с горчицей. Основная функция аллилизотиоцианата, которому обязана своей жгучестью горчица, — отпугивать насекомых и травоядных покрупнее. Как такового его нет в растении: он начинает образовываться только лишь при повреждении тканей растения. Его синтез запускается в момент повреждения листьев или семян, чтобы нанести максимальный ущерб вредителю. И лишь человек научился есть то, что придумано в качестве токсина, и называть это полезным. При этом называть вредным то же самое вещество, полученное методами химического синтеза.
Токсичные вещества для защиты от насекомых содержатся и в пупырышках огурца. А человек, ничего, ест. В миндале и абрикосе содержится очень сильный яд цианид, синильная кислота. И это не мешает человеку с удовольствием употреблять их.
Молекулы, создающие запах апельсина, расположенные в цедре и по своей формуле больше похожие на бензин, чем на еду, служат для защиты сочной мякоти и так привлекают нас своим запахом.
О пищевых добавках
Говоря о пищевых добавках, наиболее часто упоминают глутамат натрия: он и в бульонных кубиках, и в колбасе, и в сосисках. Но именно это вещество определяет вкус мяса — так называемый вкус умами, по сути, вкус белка. Это открыл японский профессор Икеда и еще в 1909 году запатентовал способ его получения. Но задолго до этого глутамат был самой распространенной химической молекулой в нашей еде. Именно это вещество придает вкус колбасе, ветчине и любым другим мясным продуктам. Глутамат дает вкус помидорам, и его концентрация увеличивается при созревании плодов. Красный помидор вкуснее зеленого отчасти потому, что в нем больше глутамата. Человек лишь научился получать глутамат натрия методом бактериологического синтеза. И этот искусственный глутамат, если верить атомно-молекулярной теории, ничем не отличается от натурального.
Пищевые добавки на упаковке продукта обозначены буквой Е с различными цифровыми индексами. И эта буква часто пугает потребителя. Хотя это всего лишь обозначает, что продукт содержит строго определенные и проверенные вещества.
Часто те же вещества в большом количестве присутствуют и в натуральных продуктах. Например, в яблоке имеется гораздо больший набор различных Е, чем в каком-либо готовом продукте. Хотя, по сути, это не важно: происхождение вещества не определяет его свойства.
Клюква содержит бензоата натрия больше, чем разрешено применять при консервировании продуктов.
Если клюкву прогнать по допускам на содержание консервантов, ее надо запретить, в ней передоз консервантов. Для чего они ей нужны? Чтобы защититься, не дать плесени и бактериям съесть ягоду и семена. Но никто на этой планете не догадается заподозрить клюкву в том, в чем подозревают пресервы или напитки. Наоборот, многие употребляют клюкву из-за ее полезных антимикробных свойств, которые, впрочем, преувеличены.
Что есть яд
Парабены (сложные эфиры парагидроксибензойной кислоты) — тоже природные вещества, растения их используют, чтобы защитить себя от вредителей. Их используют в основном в косметике. И их тоже боятся. Часто можно встретить рекламу так называемого крема без парабенов. Но возможно это только в трех случаях: 1) если вместо безопасных и проверенных парабенов в крем добавлен какой-то менее известный и изученный консервант; 2) крем стухнет сразу после открытия; 3) производитель не дурак и все же добавил парабены, но, следуя моде, соврал.
Нитрит натрия — еще один предмет страшилок. Найти его в колбасе очень легко: модная колбаса серого цвета не содержит нитрита натрия. Но не покупайте такую колбасу.
До того как нитрит натрия стали добавлять в колбасу, так называемая колбасная болезнь — ботулизм — была достаточно рядовым явлением. Само слово «ботулизм» ведет свое начало от древнеримского «колбаса». Нитрит натрия надежно убивает бактерию, производящую смертельный токсин. А если говорить о количествах, то 1 кг шпината или брокколи вам даст столько же нитрита, сколько 50 кг докторской колбасы.
А вот история про икру, деликатесный продукт, который в силу ряда причин очень подвержен порче. Для консервации икры еще недавно использовали вещество уротропин (Е 239), который с 2010 года в нашей стране запретили. Но это единственный консервант, который работал в икре. И теперь икра либо тухнет, либо в ней много других консервантов, больше, чем разрешено.
Либо она все же хорошая и безопасная, но с запрещенным уротропином. Запрещен уротропин был, потому что он при хранении разлагается с образованием формальдегида, а это яд. Но никто не задумался о количествах. Образуется его мизер. Да и икру мы ложками не едим. К тому же такое же количество формальдегида, которое можно получить с баночкой икры с уротропином, можно получить, съев один банан.
Сладкие мифы
Очередной миф связан с вредностью подсластителей, которые люди, желающие снизить вес, используют вместо сахара.Например, аспартам — это абсолютно понятная молекула, с понятным эффектом, и есть сотни исследований, подтверждающих его безопасность.
Очень распространенный миф состоит в том, что «натуральный продукт известно какой, а что вы там насинтезировали, сплошные примеси!». Это полная ерунда. Например, если сравнивать траву тархун и газировку на ароматизаторах, то в натуральном тархуне примесей больше. При этом в газировке они все известны, а в траве мы не знаем, какие могли образоваться. В натуральном кофе химических веществ гораздо больше (без малого тысяча), и свойства их изучены гораздо меньше, чем в искусственном ароматизаторе кофе. Всего на сегодняшний день в продуктах питания обнаружено более 8 тыс. душистых веществ. Из них около 4 тыс. разрешено к использованию в качестве ароматизаторов, их свойства изучены, они признаны безопасными. Около сотни таких веществ запрещено: они оказались вредными. И еще около 4 тыс. никакой проверки никогда не проходили. Таким образом, потребляя ароматизатор, вы гарантированно потребляете только вещества из проверенных 4 тыс.
Потребляя натуральное, вы едите все: и проверенные безопасные, и непроверенные, и обязательно проверенные вредные.
Наконец, любители всего натурального в магазине выберут колбасу или окорок натурального копчения, а не копченую с помощью жидкого дыма. И с точки зрения безопасности выберут гораздо более опасный продукт. Ни то ни другое не есть лучший выбор с точки зрения здоровья. Но натуральный дым содержит множество смол, канцерогенов, которые при производстве жидкого дыма отделяются. Фактически искусственное копчение намного безопаснее естественного. Пусть и не так вкусно.
«Мы хотим знать правду о еде!» — под такими лозунгами выступают защитники натуральной еды и противники химической. Это очень здорово, когда человек хочет знать правду. Только вот лучше искать эту правду не в телевизоре и не на женских форумах. А начать хотя бы с учебника по пищевой химии.
Правда о еде состоит в том, что любая еда состоит из химии. Правда в том, что если человек сам делает еду, то он знает, из чего он ее делает, и проверяет это на безопасность.
Правда в том, что пищевая химия — это тоже наука, которая делает наш мир лучше. И еще одна правда в том, что, потребляя только натуральную еду, полагаясь на природу, вы совершаете ошибку. Природа совершенно не обязана заботиться о нашей безопасности.
Какую роль играет химия в жизни человека и зачем она нужна
Развитие химической промышленности переносит жизнь человека на совершенно новый качественный уровень. Однако, большинство людей считают химию очень сложной и непрактичной наукой, занимающейся отвлеченными вещами, совершенно ненужными в жизни. Попробуем развеять этот миф.
Зачем человечеству химия
Роль химии в современном мире очень велика. На самом деле, химические процессы окружают нас постоянно, это касается не только промышленного производства или бытовых моментов.
Химические реакции в нашем собственном организме протекают ежесекундно, разлагая органические вещества до простых соединений вроде углекислого газа и воды, в результате чего мы получаем энергию на совершение элементарных действий.
Параллельно создаем новые вещества, необходимые для жизнедеятельности и работы всех органов. Останавливаются процессы только после смерти человека и его полного разложения.
Источником питания для многих организмов, в том числе и человека, являются растения, обладающие способностью вырабатывать органические вещества из воды и углекислого газа.
Этот процесс включает цепь сложных химических превращений, итогом которой становится образование биополимеров: клетчатки, крахмала, целлюлозы.
Химия в быту
Химия в быту человека присутствует ежедневно, мы сталкиваемся с осуществлением целой цепочки химических превращений при:
- использовании мыла;
- приготовлении чая с лимоном;
- гашении соды;
- поджигании спички или газовой конфорки;
- приготовлении квашеной капусты;
- использовании порошков и других моющих средств.
Все это химические реакции, в ходе которых из одних веществ образуются другие, а человек получает от этого процесса какую-то пользу. Современные порошки содержат ферменты, которые при высоких температурах разлагаются, поэтому стирка в горячей воде нецелесообразна. Эффект отъедания пятен будет минимальным.
Действие мыла в жесткой воде тоже значительно снижается, зато появляются хлопья на поверхности. Смягчить воду можно кипячением, но иногда это возможно только с помощью химических веществ, которые как раз и добавляют в средства для стиральной машины, снижающие процесс образования накипи.
Химия и организм человека
Роль химии в жизни человека начинается с дыхания и переваривания пищи.
Все процессы, происходящие в нашем организме, осуществляются в растворенном виде, а универсальным растворителем выступает вода. Ее волшебные свойства позволили когда-то возникнуть жизни на Земле, и сейчас очень важны.
Основой химического строения человека выступает пища, которую он потребляет. Чем она качественнее и полноценнее, тем лучше работает слаженный механизм жизнедеятельности.
При недостатке какого-либо вещества в питании, тормозятся протекающие процессы, и работа организма нарушается. Чаще всего, такими важными веществами мы считаем витамины. Но это наиболее заметные вещества, недостаток которых проявляется быстро. Нехватка других компонентов может быть не так видна.
К примеру, вегетарианство имеет негативные стороны, связанные с непоступлением с пищей некоторых полноценных белков и, содержащихся в них, аминокислот. В такой ситуации организм не может синтезировать некоторые собственные белки, что приводит к различным нарушениям.
Даже поваренная соль должна обязательно входить в рацион, поскольку ее ионы помогают осуществлять осмотическое давление, входят в состав желудочного сока, помогают работе сердца.
При различных отклонениях в деятельности органов и систем человек в первую очередь, обращается в аптеку, выступающую в качестве главного пропагандиста достижений человечества в области химии.
Более 90 процентов медикаментов, выставленных на полках аптек, являются искусственно синтезированными, даже если они присутствуют в природе, сегодня проще создать их на заводе из отдельных компонентов, чем вырастить в естественных условиях. И хотя многие из них имеют побочный эффект, положительное значение от устранения заболевания намного выше.
Химия на службе промышленности
Изначально науку химию двигали люди любопытные, а также жадные.
Первым было интересно узнать из чего все состоит и как превращается во что-то новое, вторым хотелось научиться создавать нечто ценное, позволяющее приобрести материальные блага.
Одним из самых ценных веществ является золото, а за ним идут и другие металлы.
Именно добыча и переработка руды для получения металлов – первые направления развития химии, они и сегодня очень важны. Поскольку позволяют получать новые сплавы, использовать более эффективные способы очистки металлов и так далее.
Производство керамики и фарфора тоже очень древнее, оно постепенно совершенствуется, хотя превзойти некоторых старинных мастеров сложно.
Переработка нефти сегодня показывает огромное значение химии, ведь помимо бензина и других видов топлива, из этого природного сырья создается несколько сотен различных веществ:
- каучуки и резины;
- синтетические ткани, такие как нейлон, лайкра, полиэстер;
- детали автомобилей;
- пластмассы;
- моющие средства и бытовая химия;
- сантехника;
- канцелярские товары;
- мебель;
- игрушки;
- и даже пища.
Лакокрасочная промышленность полностью основана на достижениях химии, все ее разнообразие создается учеными, синтезирующими новые вещества. Даже строительство сегодня вовсю применяет новые материалы, обладающие свойствами, нехарактерными природным веществам. Их качество постепенно улучшается, доказывая, что химия в жизни человека необходима.
Две стороны медали
Роль химии в современном мире огромна, жить без нее мы уже не сможем, она дает нам массу полезных веществ и явлений, но в то же время и наносит определенный вред.
Вредное воздействие химии
Как негативный фактор, химия в жизни человека появляется постоянно. Чаще всего мы отмечаем последствия в экологической сфере и здоровье населения.
Изобилие материалов, чужеродных нашей планете приводит к тому, что они засоряют почву и воду, не подвергаясь естественным процессам гниения.
При этом в ходе разложения или горения они выделяют большое количество токсичных веществ, дополнительно отравляющих окружающую среду.
И тем не менее, вопрос этот вполне разрешим с помощью той же самой химии.
Значительную часть веществ можно повторно переработать, снова превратив в нужные товары. Проблема, скорее, связана не с недостатками химии как науки, а с ленью человека, и его нежеланием потратить дополнительные усилия на переработку продуктов жизнедеятельности.
Такая же проблема связана и с отходами промышленного производства, которые сегодня редко перерабатываются качественно, отравляя окружающую среду и здоровье человека.
Второй момент, говорящий, что химия и организм человека несовместимы, это искусственная пища, которой нас пытаются пичкать многие производители. Но здесь вопрос не столько достижений химии, сколько жадности людей.
Химические успехи позволяют сделать жизнь человека проще и возможно, роль химии в решении продовольственной проблемы окажется бесценной, особенно в сочетании с достижениями генетики. Неумение пользоваться этими достижениями и желание заработать – вот главные враги здоровья человека, а вовсе не химическая промышленность.
Применение большого количества консервантов в пище стало проблемой в некоторых странах, где жители настолько пропитались этими веществами, что после смерти процессы разложения в них сильно заторможены, в результате умершие просто не сгнивают, а долгие годы лежат в земле.
Бытовая химия часто становится источником аллергических реакций и отравлений организма. Минеральные удобрения и средства для обработки растений от вредителей тоже опасны для человека, да и на природу они оказывают негативное воздействие, постепенно разрушая ее.
Польза химии
В психологии существует такое понятие – сублимация, заключающееся в снятии внутреннего напряжения через перераспределение энергии, для достижения результата в какой-то доступной области.
В химии этот термин используют как обозначение процесса получения из твердого вещества газообразного без жидкой стадии. Однако и в данной отрасли можно применить подход психологии.
Перенаправление энергии на достижения в разных отраслях, связанных с химией приносит много пользы обществу.
Говоря о том, зачем нужна химия в быту человека или промышленном производстве мы вспоминаем многие ее достижения, сделавшие нашу жизнь комфортной и более долгой:
- лекарства;
- современные материалы с уникальными свойствами;
- удобрения;
- источники энергии;
- источники пищи и многое другое.
Химия в жизни человека
Если бы химии не существовала. Зачем изучать химию
Заключение
Роль химии в современном мире неоспорима, она заняла важное место в системе знаний человечества, накопленных в течение тысячелетий. Ее активное развитие в 20 веке несколько пугает и заставляет людей задуматься о конечной цели применения своих знаний. Но без знания человечество – только отдельная группа индивидуумов, обладающая не самыми лучшими характеристиками.
Важнейшие химические вещества, применяемые в быту.
Ткип. — температура кипения,
Тпл. — температура плавления.
Адипиновая кислота (СН2)4(СООН)2— бесцветные кристаллы, растворимые в воде. Т. пл. 153 °С. Образует соли — адипинаты. Применяется для удаления накипи.
Азотная кислота HNO3— бесцветная жидкость с резким запахом, неограниченно растворимая в воде. Т. кип. 82,6 °С. Сильная кислота, вызывает глубокие ожоги и требует осторожности в обращении. Образует соли — нитраты.
Алюмокалиевые квасцы KAl(SO4)2•12Н2О — двойная соль, бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 92 °С.
Амилацетат СН3СООС5Н11 (амиловый эфир уксусной кислоты) — бесцветная жидкость с фруктовым запахом, органический растворитель и отдушка.
Аминокислоты — органические вещества, в молекулах которых имеются карбоксильные группы СООН и аминогруппы NH2. Входят в состав белков.
Аммиак NH — бесцветный газ с резким запахом, хорошо растворим в воде, образует гидрат аммиака NH3•Н2О.
Аммиачная (аммонийная) селитра, см. Нитрат аммония. Анилин (аминобензол, фениламин) C6H5NH2— вязкая бесцветная жидкость, темнеющая на свету и на воздухе. Нерастворим в воде, растворяется в этиловом спирте и диэтиловом эфире. Ткип. 184 °С. Ядовит.
Арахидоновая кислота С 19 Н 31 СООН — ненасыщенная карбоновая кислота с четырьмя двойными связями в молекуле, бесцветная жидкость. Ткип. 160—165 °С. Входит в состав растительных жиров.
Аскорбиновая кислота (витамин С), органическое вещество сложного строения — бесцветные кристаллы, чувствительные к нагреванию. Участвует в окислительно-восстановительных процессах живого организма.
Ацетальдегид (уксусный альдегид) СН3СНО — летучая бесцветная жидкость с характерным запахом, хорошо растворимая в воде. Ткип. 21 °С.
Ацетаты — соли уксусной кислоты.
Ацетат натрия (уксуснокислый натрий) CH3COONa • ЗН2О — бесцветные кристаллы, хорошо растворимые в воде. Тпл. 58 °С
(Тпл. безводного ацетата натрия 324 °С). В водной среде создаёт щелочную среду за счёт гидролиза.
Ацетат свинца (свинцовый сахар) Рb(СН3СОО)2•ЗН2О — бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 75 °С (Тпл. безводного ацетата свинца 280 °С).
Ацетон (СН3)2СО — бесцветная летучая и огнеопасная жидкость, неограниченно растворимая в воде. Ткип. 56 °С, Органический растворитель.
Белая магнезия, см. Карбонат магния.
Белки — биополимеры, состоящие из остатков аминокислот. Играют важнейшую роль в процессах жизнедеятельности.
Бензин — смесь лёгких углеводородов; получается при нефтепереработке. Ткип. от 30 до 200 °С. Горючее и органический растворитель.
Бензойная кислота С6Н5СООН — бесцветное кристаллическое вещество, плохо растворимое в воде. Выше 100 °С разлагается.
Бензол С6Н6— ароматический углеводород. Ткип. 80 °С. Горюч, ядовит.
Бертоллетова соль, см. Хлорат калия.
Бетаин (триметилглицин) ( CH3)3N + CH2COO — органическое вещество, хорошо растворимое в воде, содержится в растениях (например, в свёкле).
Борная кислота В(ОН)3— бесцветное кристаллическое вещество, малорастворимое в воде, слабая кислота.
Бромат натрия NaBrO3— бесцветные кристаллы, растворимые в воде. Плавится при 384 °С с разложением. В кислой среде — сильный окислитель.
Бура (декагидрат тетрабората натрия) Na2B4O7•10Н2О — бесцветное кристаллическое вещество, растворимое в воде.
Вазелин — светло-жёлтое или бесцветное жироподобное вещество, смесь тяжёлых углеводородов. Получается растворением парафина или церезина в тяжёлых нефтяных маслах.
Винная (виннокаменная) кислота [СН(ОН)]2(СООН)2— бесцветное кристаллическое вещество, растворимое в воде и в этиловом спирте. Образует соли — тартраты и гидротартраты.
Винный камень, см. Гидротартрат калия.
Воск — жироподобное аморфное вещество растительного происхождения, смесь сложных эфиров жирных кислот. Плавится в интервале 40—90 °С.
Галактоза С6Н 12 О6•Н2О — углевод, моносахарид, бесцветное кристаллическое вещество, растворимое в воде.
Гашёная известь, см. Гидроксид кальция.
Гексаметилентетрамин (уротропин) ( CH2)6N4— бесцветное кристаллическое вещество, растворимое в воде. Температура возгонки 230 °С. В кислой среде разлагается с выделением формальдегида и аммиака.
Гидрат аммиака NH3•Н2О — продукт взаимодействия аммиака с водой. Слабое основание.
Гидрокарбонат аммония NH4HCO3— бесцветное кристаллическое вещество, растворимое в воде, разлагается при нагревании.
Гидрокарбонат натрия (питьевая сода, пищевая сода) NaHCO3— бесцветное кристаллическое вещество, растворимое в воде. Вследствие гидролиза даёт слабощелочную реакцию раствора.
Гидроксид калия (едкое кали) КОН — бесцветное кристаллическое вещество, растворимое в воде с сильным разогреванием. Сильная щёлочь. Вызывает химические ожоги, особенно опасные для глаз.
Гидроксид кальция (гашёная известь) Са(ОН)2— белый порошок, малорастворимый в воде. Получается взаимодействием с водой («гашением») оксида кальция. Обладает щелочными свойствами. Едкое вещество.
Гидроксид натрия (едкий натр) NaOH — бесцветное кристаллическое вещество, растворимое в воде с сильным разогреванием. Сильная щёлочь. Вызывает химические ожоги, особенно опасные для глаз.
Гидроортофосфат аммония ( NH4)2HPO4— бесцветное кристаллическое вещество, хорошо растворимое в воде. Минеральное удобрение (аммофос).
Гидроортофосфат кальция (дигидрат) СаНРО4•2Н2О — вещество белого цвета. Минеральное удобрение (преципитат). При нагревании выше 360 °С отщепляет воду, выше 900 °С превращается в дифосфат кальция Са2Р2О7.
Гидроперит ( NH2)2CO •Н2О2— бесцветное кристаллическое вещество, комплексное соединение пероксида водорода с карбамидом.
Гидросульфит натрия NaHSO3— бесцветное кристаллическое вещество, хорошо растворимое в воде, обладает отбеливающими свойствами.
Гидротартрат калия (винный камень) К(НС4Н4О6)•0,5Н2О — бесцветное кристаллическое вещество, хорошо растворимое в воде, кислое на вкус. Образуется при брожении виноградного сока.
Гидрохинон С6Н4(ОН)2— бесцветное кристаллическое вещество, растворимое в воде и в растворах щелочей. Обладает восстановительными свойствами.
Гипосульфит натрия, см. Тиосульфат натрия.
Гипохлорит натрия (тригидрат) NaClO •ЗН2О — зеленовато-жёлтое кристаллическое вещество, хорошо растворимое в воде. Т. пл. 26 °С, выше 40 °С разлагается, в присутствии органических веществ взрывается. Отбеливатель.
Глауберова соль, см. Сульфат натрия.
Глицерин СН(ОН)(СН2ОН)2— бесцветная вязкая жидкость, неограниченно растворимая в воде и поглощающая влагу из воздуха, трёхатомный спирт. Входит в состав жиров в виде липидов — триг-лицеридов (эфиров глицерина с органическими кислотами).
Глюкоза (виноградный сахар) C6H12O6 — углевод, моносахарид, бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 146 °С. Содержится в соке всех растений и в крови человека и животных.
Глюконат кальция Са[СН2ОН(СНОН)4СОО]2•Н2О (моногидрат) — белый кристаллический порошок, малорастворимый в холодной воде, практически нерастворимый в этиловом спирте.
Глюконовая (сахарная) кислота СН2(ОН)(СНОН)4СООН — бесцветное кристаллическое вещество, растворимое в воде, получается при окислении глюкозы. Образует соли — глюконаты.
Двойной суперфосфат (моногидрат дигидроортофосфата кальция) Са(Н2РО4)2•Н2О — белый порошок, растворимый в воде.
Диатомит, см. Диоксид кремния.
Дибутилфталат С6Н4(СООС4Н 9 )2 (бутиловый эфир фталевой кислоты) — бесцветная жидкость с фруктовым запахом, малораcтворимая в воде. Органический растворитель и репеллент.
Дигидроортофосфат аммония NH4H2PO4— бесцветное кристаллическое вещество, растворимое в воде. Удобрение (диаммо-фос).
Диметцлфталат С6Н4(СООСН3)2 (метиловый эфир фталевой кислоты) — бесцветная летучая жидкость. Органический растворитель и репеллент.
Диоксид кремния (кремнезём) SiO2— белый порошок или прозрачные кристаллы. Тпл. 1500—1705 °С, при охлаждении затвердевает в стеклообразную массу (кварцевое стекло). Не взаимодействует с водой и кислотами, кроме плавиковой (фтороводородной). В природе встречается в виде кварца, горного хрусталя, мориона (черного кварца), кварцевого песка.
Диоксид свинца РbО2— тёмно-коричневый порошок, нерастворимый в воде. В кислой среде — сильный окислитель.
Диоксид серы (сернистый газ) SO2— бесцветный газ с резким удушливым запахом. Растворяется в воде, образуя кислоту.
Диоксид титана TiO2— белый порошок, нерастворимый в воде Пигмент и абразивное вещество.
Диоксид углерода (углекислый газ) СО2— бесцветный газ, затвердевает при обычном давлении при -78 °С, образуя «сухой лёд»/ Относительно хорошо растворим в воде, образует слабую угольную кислоту.
Дихлорэтан С2Н4Сl2— бесцветная жидкость, малорастворимая в воде. Ткип. 83 °С, хороший растворитель. Ядовит.
Дихлофос (дихлорофос) (СН3О)2Р(О)ОСН=ССl2— вязкая жидкость, растворимая в воде и органических растворителях. Ядохимикат.
Дихромат калия (хромпик) К2Сr2О7— оранжево-красные кристаллы, хорошо растворимые в воде. Тпл. 397,5 °С, при нагревании выше 600 °С разлагается. Сильный окислитель. Ядовит.
Диэтиловый эфир (С2Н5)2О — летучая бесцветная огнеопасная жидкость с характерным запахом, малорастворимая в воде. Ткип. 34,5 °С. Органический растворитель.
Диэтилтолуамид (ДЭТА) СН3С6Н4СО N (С2Н5)2— бесцветная жидкость, малорастворимая в воде. Эффективный репеллент.
Древесный спирт, см. Метиловый спирт.
Железный купорос (гептагидрат сульфата железа) F е S О4•7Н2О — зеленоватые кристаллы, растворимые в воде. На воздухе постепенно окисляется.
Железный сурик — оксид железа( III ) Fe2O3 с примесями. Минеральная краска красно-коричневого цвета.
Жёлтая кровяная соль (тригидрат гексацианоферрата ( II ) калия) K4[ Fe ( CN )6]•ЗН2О — светло-жёлтые кристаллы, растворимые в воде. В XVIII в. получалась из отходов скотобоен, откуда и название.
Жирные кислоты — карбоновые кислоты, содержащие 13 и больше атомов углерода.
Жиры (липиды) — триглицериды (эфиры глицерина) и жирных кислот.
Изоамиловый спирт (СН3)2С3Н5ОН — бесцветная жидкость с неприятным запахом. Ткип. 132 °С. Органический растворитель.
Изовалериановая кислота (СН3)2С2Н3СООН — бесцветная жидкость, растворимая в воде, диэтиловом эфире и этиловом спирте. Ткип. 176,5 °С. Содержится в корне валерианы.
Изопропиловый спирт (изопропанол) СН3СН(ОН)СН3— бесцветная жидкость, растворимая в воде. Ткип. 82 °С. Органический растворитель.
Иод I2— фиолетово-чёрные кристаллы с резким запахом, малорастворимые в воде, растворимые в органических растворителях. Легко возгоняется.
Иодид калия KI — бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 681 °С.
Калийная селитра, см. Нитрат калия.
Кальцинированная сода, см. Карбонат натрия.
Камфора С10Н16О — бесцветные кристаллы с характерным запахом. Тпл. 179 °С, легко возгоняется при нагревании. Растворяется в органических растворителях, в воде малорастворима.
Канифоль — стеклообразное вещество жёлтого цвета. Тпл.100— 140 °С, состоит из смоляных кислот — органических веществ циклического строения. Растворима в органических растворителях и уксусной кислоте, нерастворима в воде.
Карбамид (мочевина) CO ( NH2)2— бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 132,7 С С. Продукт белкового обмена в организме человека и животных, выводится с мочой.
Карболовая кислота, см. Фенол.
Карбонат аммония ( NH4)2CO3— бесцветное кристаллическое вещество, хорошо растворимое в воде, при нагревании разлагается.
Карбонат калия (поташ) К2СО3— бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 901 °С.
Карбонат кальция (мел, известняк, мрамор) СаСО3— белый кристаллический порошок, нерастворимый в воде. Разлагается при нагревании до 900 °С.
Карбонат магния (белая магнезия) MgCO3— белый рыхлый порошок, нерастворимый в воде. Взаимодействует с кислотами, при прокаливании разлагается до оксида магния (жжёной магнезии), выделяя углекислый газ.
Карбонат натрия (кристаллическая сода) Na2CO3•10Н2О — бесцветное кристаллическое вещество, растворимое в воде. Тпл. 32,5 °С. При 100 °С теряет воду, превращаясь в кальцинированную соду — безводный карбонат натрия Na2CO3. В водных растворах создает щелочную среду за счёт гидролиза.
Карбоновые кислоты — органические соединения, содержащие в молекуле одну (одноосновные) или несколько групп СООН. Примером одноосновной карбоновой кислоты является уксусная кислота, а многоосновных — адипиновая, лимонная и др.
Карбофос ( CH3O )2O ( S ) SCH ( COOC2H5) — сероорганическое соединение, вязкая жидкость, малорастворимая в воде, ядохимикат.
Каротин С40Н56 — органическое соединение сложного строения, ненасыщенный углеводород; кристаллическое вещество темнокрасного или жёлтого цвета. Тпл. 178 или 187 °С. Синтезируется растениями при поглощении света, в человеческом организме переходит в витамин А — ретинол.
Каустическая сода, см. Гидроксид натрия.
Керосин — смесь углеводородов, получается при нефтепереработке. Ткип. 150—300 °С. Топливо и органический растворитель.
Кизельгур, см. Диоксид кремния.
Клетчатка, см. Целлюлоза.
Корунд, см. Оксид алюминия.
Красная кровяная соль K3[ Fe ( CN )6] (гексацианоферрат (Ш) калия) — красные кристаллы, растворимые в воде. В XVIII в. получалась из отходов скотобоен, откуда и название.
Крахмал [С6Н10О5]n— белый аморфный порошок, полисахарид. При длительном контакте с водой разбухает, превращается в клейстер, при нагревании образует декстрин. Содержится в картофеле, муке, крупах.
Лакмус — природное органическое вещество, кислотно-основный индикатор (синий в щелочной, красный в кислой среде).
Лактоза (молочный сахар) С12Н22О11 Н2О — бесцветное кристаллическое вещество, растворимое в воде. Содержится в молоке (4—6%), выделяется при сгущении сыворотки в виде мелких рассыпчатых кристаллов с очень слабым сладким вкусом.
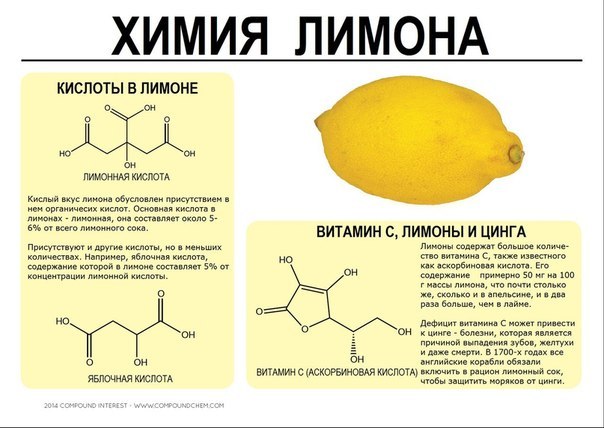
Лимонная кислота НОС(СН2СООН)2СООН — бесцветное кристаллическое вещество, растворимое в воде и этиловом спирте. Тпл. 153 °С. Образует соли — цитраты. Содержится в лимонах и других плодах.
Линолевая кислота С17Н31СООН — бесцветная жидкость, непредельная органическая кислота с двумя двойными связями в молекуле. Затвердевает при -11 °С. Содержится в растительных жирах.
Липиды, см. Жиры.
Марганцовка, см. Перманганат калия.
Масляная кислота С3Н7СООН — бесцветная жидкость с неприятным запахом. Ткип. 163 °С.
Медный купорос (пентагидрат сульфата меди) CuSO4•5Н2О — кристаллы голубого цвета, хорошо растворимые в воде. На воздухе выветриваются, покрываясь белым налётом безводного сульфата меди CuSO4.
Меркаптаны (тиоспирты) — органические соединения, содержащие группу SH , например, метилмеркаптан CH3SH . Обладают отвратительным запахом.
Метагидроксид железа FeO(OH) — буро-коричневый порошок, нерастворимый в воде, основа ржавчины.
Метасиликат натрия (нонагидрат) Na2SiO3•9Н2О — бесцветное вещество, хорошо растворимое в воде. Тпл. 47 °С, выше 100 °С теряет воду. Водные растворы (силикатный клей, растворимое стекло) имеют сильнощелочную реакцию из-за гидролиза.
Метиловый спирт (метанол, древесный спирт) СН3ОН — бесцветная легколетучая жидкость, неограниченно растворимая в воде. Ткип. 64,5 °С. Ядовит. Смертельная доза для человека 30 г, вызывают тяжёлое отравление с полной потерей зрения.
Молочная кислота СН3СН(ОН)СООН — бесцветные кристаллы, растворимые в воде. Тпл. 25 °С. Образуется при брожении лактозы и других углеводов.
Молочный сахар, см. Лактоза.
Монооксид углерода (угарный газ) СО — газ без цвета и запаха, сильный яд. Образуется при неполном сгорании органических веществ.
Мочевина, см. Карбамид.
Муравьиная кислота НСООН — бесцветная жидкость с резким запахом, неограниченно растворимая в воде, одна из самых сильных органических кислот. Ткип. 100,7 °С. Содержится в выделениях насекомых, в крапиве, хвое. Образует соли — формиаты.
Натриевая селитра, см. Нитрат натрия.
Нафталин С10Н8— бесцветное кристаллическое вещество с резким характерным запахом, нерастворимое в воде. Возгоняется при 50 °С. Ядовит.
Нашатырный спирт — 5-10%-й водный раствор аммиака.
Нашатырь, см. Хлорид аммония.
Негашеная известь, см. Оксид кальция.
Ненасыщенные (непредельные) жирные кислоты — жирные кислоты, в молекулах которых есть одна или несколько двойных связей.
Нитрат аммония (аммиачная селитра) NH4NO3— бесцветное кристаллическое вещество, хорошо растворимое в воде, поглощает влагу из воздуха. Тпл. 170 °С. Азотное удобрение.
Нитрат калия (калийная или индийская селитра) KNO3— бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 336,5 °С.
Нитрат натрия (натриевая, или чилийская, селитра) NaNO3— бесцветное кристаллическое вещество, хорошо растворимое в воде, поглощает влагу из воздуха. Тпл. 308,5 °С.
Нитрат серебра (ляпис) AgNO3— бесцветные кристаллы, растворимые в воде, этиловом спирте, диэтиловом эфире и темнеющие на свету. Тпл. 210 °С.
Озон О3— модификация кислорода, синий газ с резким запахом. Сильный окислитель. Ядовит. Образуется при электрическом разряде в атмосфере.
Оксид алюминия (корунд) А l2О3— тугоплавкий белый порошок, нерастворимый в воде.
Оксид железа(Ш) (мумия, крокус, железный сурик) Fe2O3— красно-коричневый порошок. Тпл. 1562 °С.
Оксид кальция (негашёная известь) СаО — белый порошок, взаимодействует с водой с выделением тепла и образованием гидроксида кальция (гашёной извести).
Оксид магния (жжёная магнезия) MgO — белый порошок, нерастворим в воде.
Оксид свинца (глёт) РbО — жёлтый порошок, нерастворим в воде. Тпл. 886 °С.
Оксид хрома Сr2О3— тёмно-зелёный тугоплавкий порошок, нерастворимый в воде. Распространённый пигмент.
Оксид цинка ZnO — бесцветные кристаллы, нерастворимые в воде. При нагревании до 500 °С желтеет, при 1725 °С возгоняется. Белый пигмент.
Олеиновая кислота С17Н33СООН — бесцветная жидкость, малорастворимая в воде, без запаха и вкуса. Затвердевает при 13 °С. Ненасыщенная карбоновая кислота, содержится в растительных жирах в виде триглицерида.
Ортофосфат (фосфат) кальция Са3(РО4)2— бесцветное кристаллическое вещество, нерастворимое в воде, растворимое в кислотах. Тпл. 1670 °С. Содержится в зубной и костной тканях человека и животных.
Ортофосфат натрия (тринатрийфосфат) Na3PO4— бесцветное кристаллическое вещество, хорошо растворимое в воде. В водных растворах создаёт щелочную среду из-за гидролиза.
Ортофосфорная кислота Н3РО4— бесцветное кристаллическое вещество, неограниченно растворимое в воде. Тпл. 42 °С. Образует соли — ортофосфаты, гидроортофосфаты и дигидроортофосфаты.
Пальмитиновая кислота С15Н31СООН — бесцветное воскообразное вещество. Тпл. 63 °С. Насыщенная жирная кислота. Входит в состав природных жиров в виде триглицерида.
Парафин — воскоподобное вещество, смесь предельных углеводородов с числом атомов углерода от 18 до 35. Тпл. 40—65 °С.
Пергидроль — 30%-й водный раствор пероксида водорода.
Перекись водорода, см. Пероксид водорода.
Перманганат калия КМnО4— тёмно-фиолетовые кристаллы, хорошо растворимые в воде. Разлагаются при нагревании выше 240 °С. Сильный окислитель.
Пероксид (перекись) водорода Н2О2— бесцветная жидкость, неограниченно растворимая в воде. Ткип. 150 °С (с разложением). Сильный окислитель.
Пероксоборат натрия Na2[ B2(O2)2(OH )4]•6Н2О — бесцветное кристаллическое вещество, малорастворимое в воде, окислитель. Отбеливатель.
Пероксокарбонат натрия (персоль)2Na2CO3•ЗН2О2— бесцветное малорастворимое кристаллическое вещество, поглощает влагу из воздуха. Разлагается при 140 °С, образуя карбонат натрия и выделяя кислород, в водном растворе разлагается при 70 °С. Отбеливатель (персоль).
Питьевая сода, см. Гидрокарбонат натрия.
Пищевая сода, см. Гидрокарбонат натрия.
Поваренная соль, см. Хлорид натрия.
Полисахариды — углеводы сложного строения (крахмал, целлюлоза и др.).
Пропан С3Н8— бесцветный горючий газ, углеводород.
Пропионовая кислота С2Н5СООН — бесцветная жидкость, растворимая в воде. Ткип. 141 °С. Слабая кислота, образует соли — пропионаты.
Простой суперфосфат — смесь растворимого в воде дигидроор-тофосфата кальция Са(Н2РО4)2•Н2О и нерастворимого сульфата кальция CaSO4.
Резорцин С6Н4(ОН)2— бесцветные кристаллы с характерным запахом, растворимые, в воде и этиловом спирте. Тпл. 109 — 110 °С
Салициловая кислота НОС6Н4СООН — бесцветное кристаллическое вещество, малорастворимое в холодной воде, хорошо растворимое в этиловом спирте. Тпл. 160 °С.
Сахара, см. Углеводы.
Сахароза С12Н22О11 — бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 185 °С.
Свинцовый сурик Рb3О4— мелкокристаллическое вещество красного цвета, нерастворимое в воде. Сильный окислитель. Пигмент. Ядовит.
Сера S8— кристаллическое вещество жёлтого цвета, нерастворимое в воде. Тпл. 119,3 °С.
Серная кислота H2SO4— бесцветная маслообразная жидкость без запаха, неограниченно растворимая в воде (с сильным разогреванием). Ткип. 338 °С. Сильная кислота, едкое вещество, образует соли — сульфаты и гидросульфаты.
Сернистый газ, см. Диоксид серы.
Серный цвет — тонко измельчённый порошок серы.
Сероводород H2S — бесцветный газ с запахом тухлых яиц, растворимый в воде, образуется при разложении белков. Сильный восстановитель. Ядовит.
Силикагель (полигидрат диоксида кремния) n SiO 2 · m H 2 O — бесцветные гранулы, нерастворимые в воде. Хороший адсорбент (поглотитель) влаги.
Синильная (циановодородная) кислота HCN — водный раствор циановодорода HCN. Слабая кислота, образует соли — цианиды. Сильный яд.
Скипидар — бесцветная или желтоватая жидкость со смолистым шпахом. Ткип. 150—170 °С. Летуч, хороший растворитель. Получается при перегонке живицы — сока хвойных деревьев.
Соляная (хлороводородная) кислота НСl — водный раствор хлороводорода НСl с максимальным содержанием 38%. Сильная кислота, едкое вещество, «дымит» на воздухе. Образует соли — хлориды.
Спирты — органические вещества, содержащие одну и более групп ОН, например, этиловый спирт С2Н5ОН.
Стеарин — полупрозрачная масса белого или желтоватого цвета, смесь стеариновой и пальмитиновой кислот. Тпл. 49—52 °С
Стеариновая кислота C17H35COOH — бесцветное воскоподобное вещество, нерастворимое в воде. Тпл. 69 °С. Насыщенная жирная кислота, содержится в животных жирах в виде триглицерида. Образует соли — стеараты.
Сульфат меди, см. Медный купорос.
Сульфат натрия (декагидрат) Na2SO4•10Н2О (глауберова соль) — бесцветное кристаллическое вещество, растворимое в воде. Тпл. 32,4 °С (с отщеплением воды), Тпл. безводного Na2SO4 884 °С.
Сульфид натрия (нонагидрат) Na2S•9Н2О — бесцветное кристаллическое вещество, хорошо растворимое в воде, водные растворы имеют щелочную реакцию и сильный запах сероводорода за счёт гидролиза. Тпл. 50 °С.
Сульфит натрия (гептагидрат) Na2SO3•7Н2О — бесцветное кристаллическое вещество, хорошо растворимое в воде, водные растворы имеют щелочную реакцию за счёт гидролиза. Разлагается, теряя воду, при 150 °С, Тпл. безводного Na2SO3 911 °С.
Тетраборат натрия, см. Бура.
Тетрахлорид углерода (четырёххлористый углерод) ССl4— бесцветная жидкость, нерастворимая в воде. Ткип. 77 °С. Растворитель. Ядовит.
Тетраэтилсвинец Рb(С2Н5)4— бесцветная горючая жидкость. Добавка к автомобильному топливу (в количестве до 0,08%). Ядовит.
Тиосульфат (гипосульфит) натрия (пентагидрат) Na2S2O3•5Н2О — бесцветное кристаллическое вещество, растворимое в воде. Тпл. 48 °С. Выше 100 °С обезвоживается. Разлагается кислотами.
Толуол (метилбензол) С6Н5СН3— бесцветная жидкость, нерастворимая в воде. Ткип. 111 °С. Ароматический углеводород. Растворитель. Ядовит и горюч.
Трилон Б (динатриевая соль этилендиаминтетрауксусной кислоты) Na2H2C2H4N2(CH2COO)4— бесцветные кристаллы, растворимые в воде. Умягчитель воды.
Тринатрийфосфат, см. Ортофосфат натрия.
Триполифосфат натрия Na3P3O9 — бесцветное твёрдое вещество, неограниченно растворимое в воде, водные растворы имеют щелочную среду из-за гидролиза.
Углеводороды — органические соединения состава CxHy (например, пропан С3Н8 , бензол С6Н6).
Углеводы (сахара) — органические соединения (оксиальдегиды и оксикетоны) состава Сx(Н2О)y Подразделяются на моносахариды (например, глюкоза, фруктоза), олигосахариды, в частности, дисахариды (сахароза, лактоза) и полисахариды (крахмал, целлюлоза).
Углекислый газ, см. Диоксид углерода.
Угольная кислота Н2СО3— слабая кислота, существует только в водном растворе, образует соли — карбонаты и гидрокарбонаты.
Уксусная кислота СН3СООН — бесцветная жидкость. Кристаллизуется при 17°С. Неограниченно растворима в воде и этиловом спирте. «Ледяная» уксусная кислота содержит 99,8% СН3СООН.
Уксусный альдегид, см. Ацетальдегид.
Фенол (карболовая кислота) С6Н5ОН — бесцветное кристаллическое вещество, розовеющее на свету, растворимое в воде и поглощающее влагу из воздуха. Тпл. 43 °С. Слабая органическая кислота. Антисептик.
Фенолфталеин — органический кислотно-основный индикатор; в щелочной среде малиновый, в кислой и нейтральной бесцветный.
Формалин — 30, 50% водный раствор формальдегида.
Формальдегид (муравьиный альдегид) НСНО — газ с резким запахом, конденсируется в жидкость при -19 ºС, растворим в воде. Антисептик.
Фосфат кальция, см. Ортофосфат кальция.
Фосфорная кислота, см. Ортофосфорная кислота.
Фруктоза (фруктовый сахар) С6Н12О6•Н2О — моносахарид, бесцветное кристаллическое вещество, растворимое в воде. Тпл. около 100 °С. Слаще сахарозы в полтора раза, содержится в плодах, нектаре цветов, мёде.
Фтороводород HF — бесцветный газ с удушливым запахом, хорошо растворим в воде с образованием фтороводородной (плавиковой) кислоты.
Хлорат калия (бертоллетова соль) КСlО3— бесцветное кристаллическое вещество, растворимое в воде. При нагревании выделяет кислород. Пожаро- и взрывоопасно. Хранят в увлажнённом состоянии.
Хлорид алюминия (гексагидрат) АlСl3•6Н2О — бесцветное кристаллическое вещество, растворимое в воде. Водные растворы имеют кислую реакцию из-за гидролиза. При нагревании до 100 °С разлагается.
Хлорид аммония (нашатырь) NH4Cl — бесцветное кристаллическое вещество, хорошо растворимое в воде. При нагревании выше 335 °С возгоняется с разложением на хлороводород НCl и аммиак NH3.
Хлорид бария (дигидрат) ВаС l2•2Н2О — бесцветное кристаллическое вещество, хорошо растворимое в воде. При 113 °С отщепляет воду, Тпл. безводного ВаСl2 961 °С.
Хлорид железа (Ш) (гексагидрат) FeCl3•6Н2О — кристаллическое вещество желтоватого цвета, расплывается на воздухе, хорошо растворимо в воде с частичным гидролизом, образованием коллоидного раствора гидроксидных соединений железа сложного состава и созданием сильнокислой среды.
Хлорид калия КСl — бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 776 °С.
Хлорид кальция (гексагидрат) СаСl2•6Н2О — бесцветное кристаллическое вещество, хорошо растворимое в воде. Начинает отщеплять воду при 30 °С; Тпл. безводного СаСl2 772 °С. Безводный СаСl2применяется как осушитель.
Хлорид натрия (поваренная соль) NaCl — бесцветное кристаллическое вещество, растворимое в воде. Тпл. 801 °С В природе минерал галит.
Хлорид серебра AgCl — белый светочувствительный порошок, вы падает из растворов в виде творожистого осадка, нерастворим в воде. Тпл. 455 °С.
Хлорид цинка ZnCl2— бесцветное кристаллическое вещество, хорошо растворимое в воде. Тпл. 317 °С.
Хлорная (белильная) известь (гипохлорит кальция) СаСl (СlO) — зернистый белый порошок с сильным запахом хлора, малорастворим в воде.
Хлороводород НСl — бесцветный газ с резким запахом, хорошо растворимый в воде с образованием соляной кислоты.
Хлорофос (СН3О)2Р(О)СН(ОН)ССl3— бесцветное кристаллическое вещество, растворимое в воде (до 10%). Тпл. 83 °С. Ядохимикат.
Целлюлоза (клетчатка) — волокнистый полисахарид состава [С6Н7О2(ОН)3]n , образует стенки растительных клеток и обеспечивает их прочность и эластичность. В хлопке 95—98% целлюлозы, в древесине от 40 до 85%.
Церезин (горный воск, озокерит) — ископаемый воск белого или светло-жёлтого цвета, смесь предельных углеводородов с числом атомов углерода в молекуле от 30 до 55. Тпл. около 70 °С.
Цетиловый спирт С16Н33ОН — бесцветное кристаллическое вещество, нерастворимое в воде. Тпл. 49 °С.
Цианиды — соли синильной кислоты.
Циановодород HCN — бесцветный газ с запахом миндаля, сильный яд.
Циановодородная кислота, см. Синильная кислота.
Цитраты — соли лимонной кислоты.
Щавелевая кислота (дигидрат) Н2С2О4•2H2O — бесцветное кристаллическое вещество, растворимое в воде. Возгоняется при 125 °С. Содержится в щавеле, шпинате, кислице в виде калиевой соли.
Этилацетат (уксусноэтиловый эфир) СН3СООС2Н5— бесцветная жидкость с фруктовым запахом, малорастворимая в воде. Ткип. 77 °С.
Этиленгликоль С2Н4(ОН)2 — бесцветная вязкая жидкость, неограниченно растворимая в воде. Тпл. 12,3 °С, Ткип. 197,8 °С. Ядовит.
Этиловый спирт (этанол, винный спирт) С2Н5ОН — бесцветная жидкость, неограниченно растворяется в воде. Ткип. 78 °С. Применяется как растворитель и консервант. В больших дозах — сильный яд.
Эфиры — органические вещества, включающие фрагменты спиртов либо спиртов и кислот, соединённые через атом кислорода.
Яблочная (оксиянтарная) кислота СН(ОН)СН2(СООН)2— бесцветное кристаллическое вещество, растворимое в воде. Тпл. 100 °С.
Янтарная кислота (СН2)2(СООН)2— бесцветное кристаллическое вещество, растворимое в воде. Тпл. 183 °С. Образует соли — сукцинаты.
- http://www.kristallikov.net/
- http://zozhnik.ru/pochemu-khimiya-v-ede-i-pishhevye-dobavki-ne/
- http://uchim.guru/himiya/himiya-v-zhizni-cheloveka.html
- http://www.calc.ru/164.html