«Физика — 10 класс»
В результате каких процессов может изменяться внутренняя энергия?
Как определяется работа в механике?
Работа в механике и термодинамике.
В механике работа определяется как произведение модуля силы, модуля перемещения точки её приложения и косинуса угла между векторами силы и перемещения. При действии силы на движущееся тело работа этой силы равна изменению его кинетической энергии.
Работа в термодинамике определяется так же, как и в механике, но она равна не изменению кинетической энергии тела, а изменению его внутренней энергии.
Изменение внутренней энергии при совершении работы.
Почему при сжатии или расширении тела меняется его внутренняя энергия? Почему, в частности, нагревается воздух при накачивании велосипедной шины?
Причина изменения температуры газа в процессе его сжатия состоит в следующем: при упругих соударениях молекул газа с движущимся поршнем изменяется их кинетическая энергия.
При сжатии или расширении меняется и средняя потенциальная энергия взаимодействия молекул, так как при этом меняется среднее расстояние между молекулами.
Так, при движении навстречу молекулам газа поршень во время столкновений передаёт им часть своей механической энергии, в результате чего увеличивается внутренняя энергия газа и он нагревается. Поршень действует подобно футболисту, встречающему летящий на него мяч ударом ноги. Нога футболиста сообщает мячу скорость, значительно большую той, которой он обладал до удара.
И наоборот, если газ расширяется, то после столкновения с удаляющимся поршнем скорости молекул уменьшаются, в результате чего газ охлаждается. Так же действует и футболист, для того чтобы уменьшить скорость летящего мяча или остановить его, — нога футболиста движется от мяча, как бы уступая ему дорогу.
Вычислим работу силы :</p>%0A<p>%D0%9F%D1%80%D0%B8%20%D1%80%D0%B0%D1%81%D1%88%D0%B8%D1%80%D0%B5%D0%BD%D0%B8%D0%B8%20%D0%B3%D0%B0%D0%B7%20%D1%81%D0%BE%D0%B2%D0%B5%D1%80%D1%88%D0%B0%D0%B5%D1%82%20%D0%BF%D0%BE%D0%BB%D0%BE%D0%B6%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%83%D1%8E%20%D1%80%D0%B0%D0%B1%D0%BE%D1%82%D1%83,%20%D1%82%D0%B0%D0%BA%20%D0%BA%D0%B0%D0%BA%20%D0%BD%D0%B0%D0%BF%D1%80%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5%20%D1%81%D0%B8%D0%BB%D1%8B%20%D0%B8%20%D0%BD%D0%B0%D0%BF%D1%80%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%BF%D0%B5%D1%80%D0%B5%D0%BC%D0%B5%D1%89%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BF%D0%BE%D1%80%D1%88%D0%BD%D1%8F%20%D1%81%D0%BE%D0%B2%D0%BF%D0%B0%D0%B4%D0%B0%D1%8E%D1%82.</p>%0A<p%20style=)
Геометрическое истолкование работы. Работе А’ газа для случая постоянного давления можно дать простое геометрическое истолкование.
При постоянном давлении график зависимости давления газа от занимаемого им объёма — прямая, параллельная оси абсцисс (рис. 13.2). Очевидно, что площадь прямоугольника abdc, ограниченная графиком рх = const, осью V и отрезками аb и cd, равными давлению газа, численно равна работе, определяемой формулой (13.3):
В общем случае давление газа не остаётся неизменным. Например, при изотермическом процессе оно убывает обратно пропорционально объёму (рис. 13.3). В этом случае для вычисления работы нужно разделить общее изменение объёма на малые части и вычислить элементарные (малые) работы, а потом все их сложить. Работа газа по-прежнему численно равна площади фигуры, ограниченной графиком зависимости р от V, осью V и отрезками аb и cd, длина которых численно равна давлениям p1 р2 в начальном и конечном состояниях газа.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основы термодинамики. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
источник
Внутренняя энергия газа при переходе его из одного состояния в другое изменяется. Рассмотрим, как это изменение связано с работой внешних сил над газом или газа против внешних сил. Для этого рассмотрим цилиндр с подвижным поршнем. На произвольном малом участке при движении поршня изменяется объем газа и совершается работа, равная произведению силы, действующей на поршень со стороны газа, находящегося внутри цилиндра, на перемещение поршня под действием этой силы: ΔАi = FiΔx.Работа положительна, если направление силы и перемещения совпадают и отрицательна, если они противоположны. Из этого следует, что при сжатии газа положительна работа внешних сил, а при расширении положительную работу совершает газ.Для вычисления работы, совершаемой газом при изменении его объема, в определяющем уравнении работы можно заменить силу, действующую на поршень в цилиндре, через произведение давления газа на площадь поршня. Получаем, что работа в термодинамике определяется произведением давления газа на изменение его объема:
Термодинамическая работа — способ передачи энергии, связанный с изменением внешних параметров системы.
Механическая работа определяется как:
δA=(F→dr−→), где F→ — сила, а dr−→ — элементарное (бесконечно малое) перемещение.Элементарная работа термодинамической системы над внешней средой может быть вычислена так:
δA=(F→dr−→)=P(ds−→dr−→)=PdV, где ds−→ — нормаль элементарной (бесконечно малой) площадки, P — давление и dV — бесконечно малое приращение объёма. Работа в термодинамическом процессе 1→2, таким образом, выражается так: A=∫12PdV.
Величина работы зависит от пути, по которому термодинамическая система переходит из состояния 1 в состояние 2, и не является функцией состояния системы. Это легко доказать, если учесть, что геометрический смысл определённого интеграла — площадь под графиком кривой. Так как работа определяется через интеграл, то в зависимости от пути процесса площадь под кривой, а значит, и работа, будет различна. Такие величины называют функциями процесса.Несмотря на то, что до сих пор и в физической химии используется обозначение работы A, в соответствии с рекомендациями ИЮПАК работу в химической термодинамике следует обозначать как W. Впрочем, авторы могут использовать какие угодно обозначения, если только дадут им расшифровку.
Внутренняя энергия термодинамической системы может изменяться двумя способами: посредством совершения работы над системой и посредством теплообмена с окружающей средой. Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется коли́чеством теплоты́ или просто теплотой. Теплота — это одна из основных термодинамических величин в классической феноменологическойтермодинамике. Количество теплоты входит в стандартные математические формулировки первого и второго начал термодинамики.Для изменения внутренней энергии системы посредством теплообмена также необходимо совершить работу. Однако это не макроскопическая работа, которая связана с перемещением границы системы. На микроскопическом уровне эта работа складывается из работ сил, действующих на молекулы системы на границе контакта более нагретого тела с менее нагретым, то есть энергия передаётся посредством столкновений молекул. Поэтому с точки зрения молекулярно-кинетической теории различие между работой и теплотой проявляется только в том, что совершение механической работы требует упорядоченного движения молекул на макроскопических масштабах, а передача энергии от более нагретого тела менее нагретому этого не требует.Энергия может также передаваться излучением от одного тела к другому и без их непосредственного контакта.Количество теплоты не является функцией состояния, и количество теплоты, полученное системой в каком-либо процессе, зависит от способа, которым она была переведена из начального состояния в конечное.Единица измерения в Международной системе единиц (СИ) — джоуль. Как единица измерения теплоты используется также калория. В Российской Федерации калория допущена к использованию в качестве внесистемной единицы без ограничения срока с областью применения «промышленность» .
Количество теплоты входит в математическую формулировку первого начала термодинамики, которую можно записать как ΔQ = A + ΔU. Здесь ΔU — изменение внутренней энергии системы, ΔQ — количество теплоты, переданное системе, а A — работа, совершённая системой. Однако определение теплоты должно указывать способ её измерения безотносительно к первому началу. Так как теплота — это энергия переданная в ходе теплообмена, для измерения количества теплоты необходимо пробное калориметрическое тело. По изменению внутренней энергии пробного тела можно будет судить о количестве теплоты, переданном от системы пробному телу. Без использования пробного тела первое начало теряет смысл содержательного закона и превращается в бесполезное для расчётов определение количества теплоты.Пусть в системе, состоящей из двух тел X и Y, тело Y (пробное) заключено в жёсткую адиабатическую оболочку. Тогда оно не способно совершать макроскопическую работу, но может обмениваться энергией (то есть теплотой) с телом X. Предположим, что тело X также почти полностью заключено в адиабатическую, но не жёсткую оболочку, так что оно может совершать механическую работу, но обмениваться теплотой может лишь сY. Количеством теплоты, переданным телу X в некотором процессе, называется величина QX = −ΔUY, где ΔUY — изменение внутренней энергии тела Y. Согласно закону сохранения энергии, полная работа, выполненная системой, равна убыли полной внутренней энергии системы двух тел: A = −ΔUx − ΔUy, где A — макроскопическая работа, совершенная телом X, что позволяет записать это соотношение в форме первого начала термодинамики: ΔQ = A +ΔUx.Таким образом, вводимое в феноменологической термодинамике количество теплоты может быть измерено посредством калориметрического тела (об изменении внутренней энергии которого можно судить по показанию соответствующего макроскопического прибора). Из первого начала термодинамики следует корректность введённого определения количества теплоты, то есть независимость соответствующей величины от выбора пробного тела Y и способа теплообмена между телами. При таком определении количества теплоты первое начало становится содержательным законом, допускающим экспериментальную проверку, так как все три величины, входящие в выражение для первого начала, могут быть измерены независимо.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца [1] . Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Дата добавления: 2014-11-08 ; Просмотров: 1492 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
При термодинамических процессах совершается работа. Получим выражение для этой работы.
Рассмотрим переход системы из первого состояния во второе. На бесконечно малом участке совершается работа, равная:
— полная работа, совершаемая при переходе системы из первого состояния во второе.
Полная работа, совершаемая при переходе системы из первого состояния во второе, графически равна площади, ограниченной кривой 1,2, ординатами 

Работа, совершаемая при термодинамических процессах зависит от характера процесса.
Рассмотрим работу при изотермическом, изобарическом, адиабатическом процессе.
Из уравнения Менделеева- Клапейрона имеем:
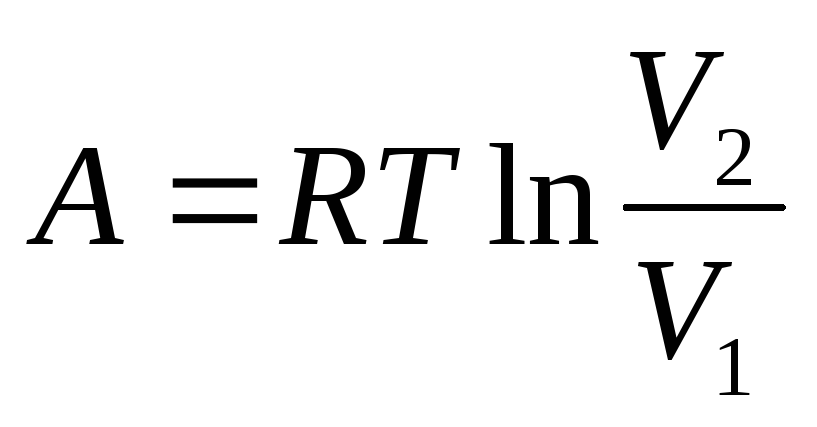


Работа при адиабатическом процессе происходит за счет изменения внутренней энергии системы.
Т.к., при адиабатическом процессе не происходит теплообмена между системой и окружающей средой 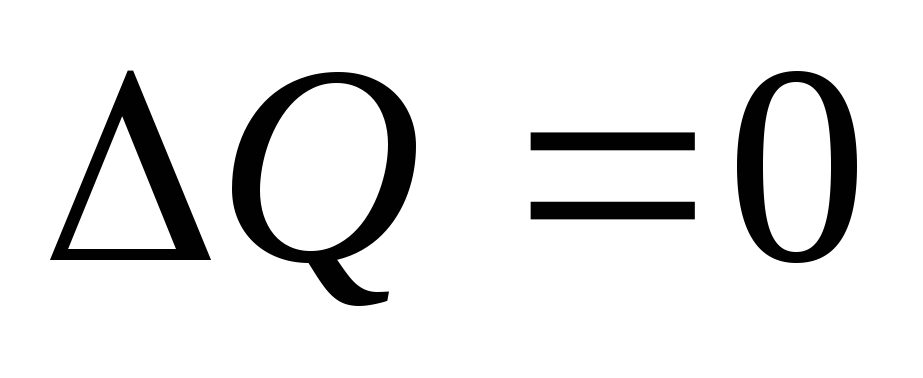

Таким образом работа при адиабатическом процессе равна:
Для описания адиабатического процесса используется уравнение Пуассона:

При адиабатическом расширении температура газа уменьшается, при адиабатическом сжатии температура увеличивается.
Машиной называется периодический действующий механизм, который, пройдя ряд термодинамических состояний, возвращается в исходное состояние и этот процесс повторяется.
Рассмотрим устройство и работу тепловой машины, изобретенной французским физиком Карно.
С помощью своей тепловой машины Карно провел важнейший опыт, который лег в основу второго начала термодинамики. Для проведения своего опыта Карно использовал цилиндрический сосуд с нетеплопроводными стенками и с теплопроводным дном, заключив в этот сосуд один моль газа. Внутри стенок сосуда перемещался поршень, который давал газу возможность изменять свой объем . В процессе проведения опыта в системе, изобретенной Карно, протекало 4 процесса: изотермическое расширение, адиабатическое расширение, изотермическое сжатие, адиабатическое сжатие. Графики этих процессов представлены на рисунке 33.
Рассмотрим работу идеальной тепловой машины, в качестве рабочего тела в которой используется один моль идеального газа (рис.33)
Газ в сжатом состоянии. Поршень в положении . Обеспечивается изотермическое расширение. Дно соприкасается с нагревателем.
источник
1) М.В. Ломоносов, проведя стройные рассуждения и простые опыты, пришел к выводу, что «причина теплоты состоит во внутреннем движении частиц связанной материи… Весьма известно, что тепло возбуждается движением: руки от взаимного трения согреваются, дерево загорается, искры вылетают при ударе кремнием о сталь, железо накаливается при ковании его частиц сильными ударами»
2) Б. Румфорд, работая на заводе по изготовлению пушек, заметил, что при сверлении пушечного ствола он сильно нагревается. Например, он помещал металлический цилиндр массой около 50 кг в ящик с водой и, сверля цилиндр сверлом, доводил воду в ящике до кипения за 2.5часа.
3) Дэви в 1799 году осуществил интересный опыт. Два куска льда при трении одного о другой начали таять и превращаться в воду.
4) Корабельный врач Роберт Майер в 1840 году во время плавания на остров Яву заметил, что после шторма вода в море всегда теплее, чем до него.
В механике работа определяется как произведение модулей силы и перемещения: A=FS. При рассмотрении термодинамических процессов механическое перемещение макротел в целом не рассматривается. Понятие работы здесь связывается с изменением объема тела, т.е. перемещением частей макротела друг относительно друга. Процесс этот приводит к изменению расстояния между частицами, а также часто к изменению скоростей их движения, следовательно, к изменению внутренней энергии тела.
Пусть в цилиндре с подвижным поршнем находится газ при температуре T1 (рис.). Будем медленно нагревать газ до температуры T2. Газ будет изобарно расширяться, и поршень переместится из положения 1 в положение 2 на расстояние Δl. Сила давления газа при этом совершит работу над внешними телами. Так как p = const, то и сила давления F = pS тоже постоянная. Поэтому работу этой силы можно рассчитать по формуле A=F Δ l =pS Δ l =p Δ V , A= p Δ V
где ΔV — изменение объема газа. Если объем газа не изменяется (изохорный процесс), то работа газа равна нулю.
Почему при сжатии или расширении меняется внутренняя энергия тела? Почему при сжатии газ нагревается, а при расширении охлаждается?
Причиной изменения температуры газа при сжатии и расширении является следующее: при упругих соударениях молекул с движущимся поршнем их кинетическая энергия изменяется.
- Если газ сжимается, то при столкновении движущийся навстречу поршень передаёт молекулам часть своей механической энергии, в результате чего газ нагревается;
- Если газ расширяется, то после столкновения с удаляющимся поршнем скорости молекул уменьшаются. в результате чего газ охлаждается.
При сжатии и расширении меняется и средняя потенциальная энергия взаимодействия молекул, так как при этом меняется среднее расстояние между молекулами.
Работа внешних сил, действующих на газ
- При сжатии газа, когда Δ V = V 2 – V 1 0, направления силы и перемещения совпадают;
- При расширении, когда Δ V = V 2 – V 1 > 0 , A
Запишем уравнение Клапейрона-Менделеева для двух состояний газа:
Следовательно, при изобарном процессе
Если m = М (1 моль идеального газа), то при ΔΤ = 1 К получим R = A. Отсюда вытекает физический смысл универсальной газовой постоянной: она численно равна работе, совершаемой 1 моль идеального газа при его изобарном нагревании на 1 К.
Геометрическое истолкование работы:
На графике p = f(V) при изобарном процессе работа равна площади заштрихованного на рисунке а) прямоугольника.
Если процесс не изобарный (рис. б), то кривую p = f(V) можно представить как ломаную, состоящую из большого количества изохор и изобар. Работа на изохорных участках равна нулю, а суммарная работа на всех изобарных участках будет равна площади заштрихованной фигуры. При изотермическом процессе (Т = const) работа равна площади заштрихованной фигуры, изображенной на рисунке в.
источник
Изменение энтропии определяет направление и предел течения самопроизвольных процессов для изолированных систем, то есть для систем, внутренняя энергия и объем которых постоянны, или для систем, в которых постоянны энтальпия и давление.
Рассмотрим изотермические процессы.
1 Направление и предел течения самопроизвольных процессов для систем, находящихся при постоянных температуре и объеме (T=const.и V=const.), определяет изохорно — изотермический потенциал (изохорный потенциал) или энергия Гельмгольца:
, (25)
где U – внутренняя энергия системы, S – энтропия системы, T – абсолютная температура.
Изохорно-изотермический потенциал является функцией состояния, его изменение при переходе системы из состояния 1 в состояние 2 определяется разностью значений в конечном и начальном состояниях .
При переходе из состояния 1 в состояние 2 термодинамическая система выполнит максимальную работу, если этот переход является обратимым процессом.
Согласно первому закону термодинамики , следовательно, работа . Согласно второму закону термодинамики из уравнения (19) для обратимого процесса .
Следовательно, при переходе из состояния 1 в состояние 2 система совершит работу
.
Функцию Fназывают свободной энергией при постоянном объеме. Свободная энергия – это та часть внутренней энергии процесса, которая может быть полностью превращена в работу. Эту работу ( ) называют максимальной работой в изотермическом процессе. Ту часть внутренней энергии, которая не превращается в работу, ( ) называют связанной энергией. С ростом энтропии системы ее связанная энергия возрастает.
Так как необратимые процессы сопровождаются возрастанием энтропии системы, величина связанной энергии будет увеличиваться, а величина свободной энергии — уменьшаться. Следовательно, процесс протекает самопроизвольно, если ΔF 0, то самопроизвольно процесс протекать не может. Если ΔF=0, то система находится в равновесии.
Таким образом, в системах, находящихся при постоянных температуре и объеме (T=const. и V=const.), самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением изохорно-изотермического потенциала F.
Причем, пределом их протекания, то есть условием равновесия, является достижение некоторого минимального для данных условий значения функции F, то есть условие
.
2 Направление и предел самопроизвольного протекания процесса для систем, находящихся при постоянных давлении и температуре (p=const.и T=const.), определяет изобарно-изотермический потенциал (изобарный потенциал) или энергия Гиббса:
, (26)
где Н – внутренняя энергия системы, S – энтропия системы, T – абсолютная температура.
Так как , то .
Изменение изобарно-изотермического потенциала для любого процесса
; (27)
для изобарного процесса (p=const.)
; (28)
для всякого изотермического процесса (T=const.)
. (29)
Максимально полезной работой изотермического процесса называют величину
. (30)
Так как и , то
, (31)
то есть максимальная полезная работа изотермического процесса равна максимальной работе за вычетом работы против внешнего давления.
Таким образом, в системах, находящихся при постоянных температуре и давлении (T=const. и р=const.), самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением изобарно-изотермического потенциала G.
Причем, пределом их протекания, то есть условием равновесия, является достижение некоторого минимального для данных условий значения функции G, то есть условие
.
Таким образом, для оценки хода любого термодинамического процесса существует определенная характеристическая функция (G, F, U, H, S), изменение которой определяет характер течения данного процесса.
Выбрать функцию, которая является характеристической для процесса, протекающего при двух постоянных термодинамических параметрах, можно из рисунка 5.
Рис. 5. Схема выбора характеристической функции процесса
При T=const.и V=const. характеристической функцией является изохорно-изотермический потенциал F.
При T=const. и р=const. – изобарно-изотермический потенциал G.
Изобарные процессы (р=const.) характеризует энтальпия Н.
Изохорные (V=const.) – внутренняя энергия U.
Термодинамические процессы (химические реакции) будут протекать в прямом направлении, соответствующем записи уравнения реакции (слева направо), если изменение соответствующей характеристической функции является отрицательным.
Исключение составляют адиабатические процессы (U и V — const. и Н и р — const.), характеристической функцией которых является энтропия S. В этом случае процесс протекает, если изменение энтропии будет положительным (ΔS >0).
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10038 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
ТЕМА: “РЕШЕНИЕ ЗАДАЧ НА РАССЧЕТ РАБОТЫ В ТЕРМОДИНАМИКЕ МЕТОДОМ ДИАГРАММ СОСТОЯНИЙ”.
Тип урока: урок закрепления изучаемого материала.
Обучающие:
б) закрепить теоретические знания о работе;
в) научиться применять знания на практике для решения задач: стандартных и нестандартных.
а) организовать процесс решения задач по расчёту работы в термодинамике методом диаграмм состояний по нарастающей сложности задач;
б) активизировать учебно-познавательную деятельность учащихся с помощью проблемных ситуаций, ситуаций конкуренции, ситуаций успеха.
а) развивать умение представлять словесную информацию в графическом и алгебраическом виде.
а) развивать умение анализировать, сравнивать;
б) развивать умение обобщать и систематизировать;
в) развивать умение разрешать проблемы.
Воспитывающие
а) воспитывать уверенность в своих силах;
б) воспитывать в себе “небоязнь” сложных задач.
а) воспитывать умение отстаивать свою точку зрения;
б) воспитывать умение слушать, спорить;
б) воспитывать умение интенсивно трудиться умственно.
Оборудование. Дидактический материал.
3. Задачник. Л. А. Кирик. Физика-10. Разноуровневые самостоятельные и контрольные работы. М.: “Илекса”, 2004. – 192.: ил.
Сегодня второй урок по теме: “ Работа в термодинамике”. Усвоили ли Вы на первом уроке физическую сущность работы в термодинамических процессах? Решение задач сегодня это покажет. Наш урок пройдёт в форме аукциона. Аукцион (“auctio” (лат.) – продажа с публичных торгов) – способ продажи, при котором товар предварительно выставляют для осмотра. Я выставляю типы задач на аукцион, объявляю количество баллов за каждый тип. Вы предлагаете ответы, получаете за них баллы, которые будут суммироваться индивидуально у каждого из Вас. В конце урока суммированные баллы определят Ваши отметки. За урок можно получить одну и более отметок. (1 минута)
Основная часть. Аукцион задач.
1. Начнём с “аукциончика” графиков (проецирую на экран слайд с графиками через графопроектор).
Задача №1. На аукцион выставлены три очень известных графические зависимости в осях (p,V). (Рис. 1).
Какую информацию Вы можете извлечь из этих диаграмм?
Отвечайте, пожалуйста, по одному. Правильный ответ – 0,5 балла.
1. первый процесс – изобарное расширение.
2. второй процесс – изохорное уменьшение давления.
3. третий процесс – изотермическое сжатие.
8. А3 0 Работа на участке 2 – 3 максимальна по модулю.
Полная работа за цикл положительна.
(Учащиеся выполняют задачу в тетрадях и, получив ответ, поднимают руку. Учитель подходит, проверяет и выставляет 5 баллов за правильное решение. Через отведенное время проецируется решение задачи через графопроектор. Решение на слайде пишет и поясняет ученик, который сделал задачу первым).
Итоги “аукциона сложных задач”. (Объявляю баллы).
5. На аукцион выставляется сложная задача. Эта задача № 5 на карточке лежащей, на парте. (Приложение). Ее правильное решение оценивается в 5 баллов. Итак, “Аукцион сложных задач”. Время выполнения задачи 5 минут.
Задача №5. С молем идеального одноатомного газа совершен цикл, изображенный на рис. 5. Температуры газа в различных состояниях равны Т1, Т2, Т3, Т4. Найдите работу газа за цикл.
Подсказка-вопрос: А что Вы предполагаете делать? (Ответ: Изобразить данный цикл в координатах (p,V).)
Вопрос: Подумайте, а стоит ли?
Из рис. 5 видно, что на участках 1 – 2 и 3 – 4 реализуется прямая пропорциональная зависимость давления от температуры, т. е., как следует из закона Менделеева — Клапейрона, объем газа при этом не меняется, а значит, и работы газ не совершает.
Необходимо найти работу газа лишь при изобарических процессах 2 — 3 и 4 — 1.
На участке 2 — 3 совершенная работа будет равна А23 = р2 (V3 – V2).
На участке 4 — 1 совершенная работа будет равна А41 = р1 (V1 – V4).
Уравнение Менделеева — Клапейрона записывается в виде p V=? R T.
Подставляя эти значения в выражение для работы, получаем окончательно:
(Решение проецируется через графопроектор. Решение на слайде пишет и поясняет ученик, сделавший задачу первым).
Итоги “аукциона сложных задач”. (Объявляю баллы.)
6. Наконец, на аукцион выставляется самая сложная на сегодняшний урок задача.
Начинаем “Аукцион конкурсных задач”. Эта задача № 6 на карточке лежащей, на парте. (Приложение). Правильное решение задачи оценивается в 5 + 5 баллов. Время решения 7 мин.
Тем, кого не устраивает эта задача, предлагаю решить №1 (высокий уровень) стр. 40 задачника. Правильное решение – 5 баллов.
Один моль идеального газа совершает замкнутый процесс, состоящий из двух изохор и двух изобар (Рис. 6). Температура в точке1 равна T1, в точке 3 — T3. Определить работу, совершаемую газом за цикл, если точки 2 и 4 лежат на одной изотерме.
На участках 1 —2 и 3 —4 работа равна нулю.
Полная работа газа за цикл: А = А23 + А41.
Процесс 1—2 — изохорический, поэтому T1 / T2 = р1 / р2 .
Окончательно получаем: А = v R (vT3. – v T1)?.
Над одним молем идеального газа совершается цикл, показанный графически на рисунке 7. Какую работу совершает газ во время этого процесса? Данные взять с рисунка.
Подсказка-вопрос: А что Вы предполагаете делать? (Ответ: Изобразить данный цикл в координатах (p,V)).
Нарисуем график зависимости в координатах (p,V).) для данного процесса (рис. 8).
На участке 1 —2 давление меняется по закону р = V, где — некоторая постоянная.
Выразим температуру газа через давление: Т = р 2 / 2 и подставим в уравнение Менделеева—Клапейрона. Получим р = 2 V/vR. Давление прямо пропорционально объему. На этом участке газ совершает положительную работу. Процесс 2—3 — изохорический, во время этого процесса работа равна нулю. В изобарическом процессе 3—1 работа совершалась над газом, т. е. газ совершал отрицательную работу. Полная работа газа равна площади треугольника 1 2 3:
(Решение пишет на доске и поясняет первый ученик, решивший задачу).
Итоги “Аукциона конкурсных задач”. (Объявляю баллы.)
7. В заключение урока предлагаю “аукцион олимпиадных задач”. Пятерка достанется только одному ученику за идею и мгновенный ответ.
Газ переводят из состояния 1 в состояние 3 в процессе, изображенном на диаграмме в координатах (p,V). (Проецирую на экран слайд через графопроектор).
Линии 1 – 2 и 2 – 3 представляют собой полуокружности равных диаметров. Найти работу газа в данном процессе. Данные взять с диаграммы.
Преобразуем графическую зависимость к виду:
Работа газа численно равна площади прямоугольника:
(Решение проецируется через графопроектор. Решение на слайде пишет и поясняет первый ученик, решивший задачу).
Задание на дом. . Предлагается решить достаточно сложную задачу №8. Её цена 5 + 5 баллов. Задача №8 помещена на стенде кабинета.
Тем, кого не устраивает эта задача, предлагаю решить № 31. 1 и 31. 4 на стр. 160 учебника под ред. А. А. Пинского.
Задача №8. Найдите работу, совершенную молем идеального газа в цикле, состоящем из двух участков линейной зависимости давления от объема и изохоры (рис. 12). Точки 2 и 3 лежат на изотерме, прямая 3— 1 проходит через начало координат. Заданы температуры Т1, и Т2, Т3. .
Работа на изохоре 1 – 2 равна нулю. Работа на участке 2 – 3 равна площади трапеции. Учтя, что
Поскольку прямая 3 – 1 проходит через начало координат и, следовательно, р1/V1 = р3/V3 получаем:
Т 1/V1 2 = Т 2/V2 2 = Т 3/V3 2 . Поэтому работу А 23 можно окончательно записать в виде:
Работа на участке 3—1 тоже равна площади трапеции:
Искомая работа в цикле равна:
Для участка прямой 2—3, соединяющего точки изотермы, так же как и для самой изотермы, работа газа определяется лишь отношением объемов. Работа же газа вдоль участка произвольной прямой, проходящей через начало координат на диаграмме р V, определяется лишь разностью температур конечного и начального состояний.
Сегодня было выставлено на интеллектуальный аукцион немало задач, и вы с ними справились. “Много задач вместе иногда решить легче, чем одну из них, если то большее число задач хорошо согласовано, а одна задача сама по себе изолирована” (Д. Пойа). Не правда ли?
Окончательные итоги. Максимальное количество решенных задач за урок –
Максимальная оценка за урок –
(Объявляю оценки. Некоторые учащиеся могут получить за урок несколько оценок за интенсивную умственную работу).
Надеюсь, все получили удовольствие от интеллектуальной деятельности.
1. Физика: Учеб. для 10 кл. шк. и кл. с углубл. изучением физики / О. Ф. Кабардин, В. В. Орлов, Э. Е. Эвенчик. ; под ред. А. А. Пинского. – 7-е изд. –М.: Просещение, 2002. – 415 с.: ил.
2. Л. А. Кирик. Физика-10. Разноуровневые самостоятельные и контрольные работы. М.: “Илекса”, 2004. – 192 с.: ил.
3. Практикум абитуриента. Молекулярная физика, оптика, квантовая физика. Под ред. В. В Можаева и А. И. Черноацана. Приложение к журналу “Квант” №2, 1995. – М.: – Бюро “Квантум”.
4. Ю. А. Конаржевский. Анализ урока. М.: – Центр “педагогический поиск”, 2003. – 336с.
источник
Энергия любой системы, вообще говоря, зависит не только от свойств самой системы, но также и от внешних условий. Внешние условия, в которых находится система, можно характеризовать заданием некоторых величин, называемых внешними параметрами. Одним из таких параметров, как уже отмечалось, является объем системы, Взаимодействие тел, при котором происходит изменение их внешних параметров, называется механическим взаимодействием, а процесс передачи энергии от одного тела к другому при таком взаимодействии – работой. Термин «работа» используется и для обозначения физической величины, равной энергии, переданной (или полученной) телом при совершении работы.
В механике работа определяется как произведение проекции силы на направление перемещения на величину перемещения. Работа совершается при действии на движущееся тело силы и равна изменению его кинетической энергии. В термодинамике движение тела как целого не рассматривается. Здесь работа, производимая системой (или над системой), связана со смещением ее границ, т.е. с изменением ее объема. Это имеет место, например, при расширении (или сжатии) газа, находящегося в цилиндре под поршнем. При равновесных процессах элементарная работа , совершаемая газом (или над газом) при бесконечно малом изменении объема на определится как
(5.4)
где dh – бесконечно малое смещение поршня (границы системы), p – давление газа. Видим, что при расширении газа ( ) совершаемая им работа положительна ( ), а при сжатии ) – отрицательна ( ).
Таким же выражением определяется работа, совершаемая любой термодинамической системой (или над системой) при бесконечно малом изменении объема. Из формулы (5.4) следует, что если сама система совершает работу (что имеет место при расширении), то работа положительна, если же работа совершается над системой (при сжатии), то совершаемая ею работа отрицательна. Как видим, в термодинамике знаки работы противоположны знакам работы в механике.
При конечном изменении объема от V1 до V2 работу можно определить, проинтегрировав элементарную работу в пределах от V1 до V2:
(5.5)
Численное значение работы равно площади криволинейной трапеции, ограниченной кривой и прямыми и (рис. 5.1). Поскольку площадь, ограниченная осью V и кривой p(V), различна, то будет различна и термодинамическая работа. Отсюда следует, что термодинамическая работа зависит от пути перехода системы из состояния 1 в состояние 2 и при замкнутом процессе (цикле) она не равна нулю. На этом основана работа всех тепловых двигателей (подробно об этом будет сказано в п. 5.7).
Используем эту формулу для получения работы газа при различных изопроцессах. При изохорном процессе V = const, и поэ-
| Рис. 5.1 |
тому работа A = 0. При изобарном процессе p = const работа . При изотермическом процессе чтобы произвести интегрирование по формуле (5.5), следует в ее подынтегральной функции выразить p через V по формуле закона Клапейрона – Менделеева:
где – число молей газа. С учетом этого получим
(5.6)
Внутренняя энергия, согласно формуле (5.1), может изменяться как за счет изменения (повышения или понижения) уровней энергии системы, так и за счет перераспределения вероятностей ее различных состояний, т.е. за счет переходов системы из одних состояний в другие. Выполнение термодинамической работы связано только со смещением (или деформацией) уровней энергии системы без изменения распределения ее по состояниям, т.е. без изменения вероятностей Так, в случае системы, состоящей из невзаимодействующих частиц (как, например, в случае идеального газа), когда можно говорить об энергиях отдельных частиц , выполнение работы связано с изменением энергии отдельных частиц ( ) при неизменном числе частиц на каждом энергетическом уровне. Схематически на примере простейшей двух уровневой системы это показано на рис. 5.2. Напри-
| Рис. 5.2 |
мер, при сжатии газа поршнем поршень, перемещаясь, сообщает одинаковую энергию всем сталкивающимся с ним молекулам, которые передают энергию молекулам следующего слоя и т.д. В результате возрастает энергия каждой частицы на одну и ту же величину. В качестве другого простейшего примера зависимости уровней энергии системы от ее внешнего параметра можно привести выражение для энергии микрочастицы в одномерной бесконечно глубокой потенциальной яме
где m – масса частицы, l – размер области движения частицы, n – целое число, исключая нуль. Внешним параметром в данном случае является ширина ямы . При изменении ширины ямы на уровни энергии смещаются на При увеличении ширины ямы уровни энергии сдвигаются вниз , а при уменьшении – вверх
В отличие от механической работы, которая равна изменению кинетической энергии тела, термодинамическая работа равна изменению его внутренней энергии.
Следует отметить также, что термодинамическая работа, как и работа механическая, совершается при протекании процесса изменения состояния, поэтому она зависит от вида процесса, и функцией состояния не является.
Ранее, в параграфе 6.1 мы говорили о равновесных состояниях термодинамической системы; в этих состояниях параметры системы одинаковы во всём её объёме. Приступая к рассмотрению работы в термодинамических системах, следует ожидать, что её совершение связано с изменением объёма системы. И тогда возникает вопрос, о каких же процессах идёт речь, если рассмотрению подлежат равновесные состояния? Ответ состоит в следующем: если процесс идёт медленно, то значения параметров состояния во всём объёме можно считать одинаковыми. Понятие «медленно» здесь следует уточнить. Прежде всего, оно связано с понятием «время релаксации» – временем, в течение которого устанавливается равновесие в системе. Нас сейчас интересует время выравнивания давления в системе (время релаксации), когда термодинамической системой совершается работа, связанная с изменением объёма; для однородного газа это время составляет
10–16с.Очевидно, время релаксации достаточно незначительно по сравнению со временем протекания процессов в реальных термодинамических системах (или по сравнению со временем измерения). Естественно, мы вправе считать, что реальный процесс есть последовательность равновесных состояний и поэтому имеем право изобразить его линией на графике V, P (рис. 6.1.). Разумеется, по осям координатной системы могут откладываться объём и температура или давление и температура. Поскольку в алгебре, и не только, при построении графиков первой координатной осью читается и записывается х, а затем – у, т. е.«х, у», есть надежда, что читатель, прочитывая «оси координатной системы V, Р», предполагает – по оси х откладывается объём V, а по оси у – давление газа Р.
Ознакомимся с видом линий, отображающих графически простейшие процессы в системе координат, по осям которой отложены параметры состояния V, P (возможны иные координатные оси). Выбор координатной системы обусловлен тем, что площадь, ограниченная кривой процесса и двумя крайними координатами для начального и конечного значений объёма, равна работе сжатия или расширения. На рис. 6.2 приведены графики изопроцессов, проведённые из одного и того же начального состояния. Кривая адиабатического процесса (адиабата) идёт круче, чем для изотермического процесса (изотерма). Это обстоятельство можно объяснить на основании уравнения Клапейрона для состояния газов:
(2)
Выражая из уравнения состояния Р1 и Р2, разность давлений при расширении газа от объёма V1 до объёма V2 запишется:
. (3)
Здесь, как и в уравнении ( 2 ), .
При адиабатическом расширении работа над внешними телами совершается только за счёт внутренней энергии газа, вследствие чего внутренняя энергия, а вместе с ней и температура газа уменьшаются; т. е. в конце адиабатического процесса расширения (рис. 6.2) Т2
| Механическая работа | |||
| W = F ⋅ S = F ⋅ S ⋅ cos φ >\cdot >=F\cdot S\cdot \cos \varphi > | |||
| Работа силы | |||
| Ключевые статьи | |||
Работа в физике
Размерность
Известные учёные
| |||
| См. также: Портал:Физика |
Мeханическая работа — это физическая величина — скалярная количественная мера действия силы (равнодействующей сил) на тело или сил на систему тел. Зависит от численной величины и направления силы (сил), и от перемещения тела (системы тел)[1].
Работа обычно обозначается буквой A (от нем. Arbeit — работа, труд) или буквой W (от англ. work — работа, труд).
Суммарная работа по перемещению одной материальной точки, совершаемая несколькими силами, приложенными к этой точке, определяется как работа равнодействующей этих сил (их векторной суммой). Поэтому дальше будем говорить об одной силе, приложенной к материальной точке.
При прямолинейном движении материальной точки и постоянном значении приложенной к ней силы работа (этой силы) равна произведению проекции вектора силы на направление движения и длины вектора перемещения, совершённого точкой:
A = F s s = F s c o s ( F , s ) = F → ⋅ s → s=Fs\ \mathrm
Здесь точкой обозначено скалярное произведение, s → >> — вектор перемещения; подразумевается, что действующая сила F → >> постоянна в течение времени, за которое вычисляется работа.
В общем случае, когда сила не постоянна, а движение не прямолинейно, работа вычисляется как криволинейный интеграл второго рода по траектории точки[2]:
(подразумевается суммирование по кривой, которая является пределом ломаной, составленной из последовательных перемещений d s → , >,> если вначале считать их конечными, а потом устремить длину каждого к нулю).
Если существует зависимость силы от координат[3], интеграл определяется[4] следующим образом:
где r → 0 >_> и r → 1 >_> — радиус-векторы начального и конечного положения тела соответственно.
- Следствие. Если направление приложенной силы ортогонально перемещению тела, или перемещение равно нулю, то работа (этой силы) равна нулю.
Работа сил по перемещению системы материальных точек определяется как сумма работ этих сил по перемещению каждой точки (работы, совершённые над каждой точкой системы, суммируются в работу этих сил над системой).
Даже если тело не является системой дискретных точек, его можно разбить (мысленно) на множество бесконечно малых элементов (кусочков), каждый из которых можно считать материальной точкой и вычислить работу в соответствии с определением выше. В этом случае дискретная сумма заменяется на интеграл.
- Эти определения могут быть использованы как для вычисления работы конкретной силы или класса сил, так и для вычисления полной работы, совершаемой всеми силами, действующими на систему.
Кинетическая энергия вводится в механике в прямой связи с понятием работы.
Схема рассуждений такова: 1) попробуем записать работу, совершаемую всеми силами, действующими на материальную точку и, пользуясь вторым законом Ньютона (позволяющим выразить силу через ускорение), попытаться выразить ответ только через кинематические величины, 2) убедившись, что это удалось, и что этот ответ зависит только от начального и конечного состояния движения, введём новую физическую величину, через которую эта работа будет просто выражаться (это и будет кинетическая энергия).
Если A t o t a l > — полная работа, совершённая над частицей, определяемая как сумма работ, совершенных приложенными к частице силами, то она выражается как:
A t o t a l = Δ ( m v 2 2 ) = Δ E k , =\Delta \left(>>\right)=\Delta E_
где E k > называется кинетической энергией. Для материальной точки кинетическая энергия определяется как половина произведения массы этой точки на квадрат её скорости и выражается как[5]:
Для сложных объектов, состоящих из множества частиц, кинетическая энергия тела равна сумме кинетических энергий частиц.
Сила называется потенциальной, если существует скалярная функция координат, известная как потенциальная энергия и обозначаемая E p > , такая что
Если все силы, действующие на частицу консервативны, и E p > является полной потенциальной энергией, полученной суммированием потенциальных энергий соответствующих каждой силе, тогда:
| F → ⋅ Δ s → = − ∇ → E p ⋅ Δ s → = − Δ E p ⇒ − Δ E p = Δ E k ⇒ Δ ( E k + E p ) = 0 >\cdot \Delta >=->E_ \cdot \Delta >=-\Delta E_ \Rightarrow -\Delta E_ =\Delta E_ )=0> . |
Этот результат известен как закон сохранения механической энергии и утверждает, что полная механическая энергия в замкнутой системе, в которой действуют консервативные силы,
является постоянной во времени. Этот закон широко используется при решении задач классической механики.
В термодинамике работа, совершенная газом при расширении[6], рассчитывается как интеграл давления по объёму:
Работа, совершенная над газом, совпадает с этим выражением по абсолютной величине, но противоположна по знаку.
- Естественное обобщение этой формулы применимо не только к процессам, где давление есть однозначная функция объема, но и к любому процессу (изображаемому любой кривой в плоскости PV), в частности, к циклическим процессам.
- В принципе, формула применима не только к газу, но и к чему угодно, способному оказывать давление (надо только чтобы давление в сосуде было всюду одинаковым, что неявно подразумевается в формуле).
Эта формула прямо связана с механической работой. Действительно, попробуем написать механическую работу при расширении сосуда, учитывая, что сила давления газа будет направлена перпендикулярно каждой элементарной площадке, равна произведению давления P на площадь dS площадки, и тогда работа, совершаемая газом для смещения h одной такой элементарной площадки будет
Видно, что это и есть произведение давления на приращение объема вблизи данной элементарной площадкой. А просуммировав по всем dS получим конечный результат, где будет уже полное приращение объема, как и в главной формуле параграфа.
Рассмотрим несколько детальнее, чем это было сделано выше, построение определения энергии как риманова интеграла.
Пусть материальная точка M движется по непрерывно дифференцируемой кривой G = > , где s — переменная длина дуги, 0 ≤ s ≤ S и на неё действует сила F ( s ) , направленная по касательной к траектории в направлении движения (если сила не направлена по касательной, то будем понимать под F ( s ) проекцию силы на положительную касательную кривой, таким образом сведя и этот случай к рассматриваемому далее). Величина F ( ξ i ) △ s i , △ s i = s i − s i − 1 , i = 1 , 2 , . . . , i τ )\triangle s_,\triangle s_=s_-s_
В соответствии с определением интеграла Римана, можем дать определение работе:
Предел, к которому стремится сумма ∑ i = 1 i τ F ( ξ i ) △ s i ^
Таким образом, если обозначить эту работу буквой W , то, в силу данного определения,
W = lim | τ | → 0 ∑ i = 1 i τ F ( ξ i ) △ s i ^
Если положение точки на траектории её движения описывается с помощью какого-либо другого параметра t (например, времени) и если величина пройденного пути s = s ( t ) , a ≤ t ≤ b является непрерывно дифференцируемой функцией, то из формулы (1) получим
W = ∫ a b F [ s ( t ) ] s ′ ( t ) d t . F[s(t)]s'(t)dt.>
Единицей измерения работы в Международной системе единиц (СИ) является джоуль, в СГС — эрг
1 Дж = 1 кг·м²/с² = 1 Н·м 1 эрг = 1 г·см²/с² = 1 дин·см 1 эрг = 10−7 Дж
В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Но скорости молекул тела меняются! Поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется — поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии. Линия, изображающая адиабатный процесс на какой-либо термодинамической диаграмме, называется адиабатой.
Олег гольцов
работа А=p(v1-v2)
где
p — давление создаваемое поршнем= f/s
где f-сила действующая на поршень
s — площадь поршня
примечание p=const
v1 и v2 — начальные и конечные обьемы.
источник
- http://studopedia.su/12_9004_rabota-v-termodinamike.html
- http://studfiles.net/preview/2482063/page:13/
- http://www.sites.google.com/site/opatpofizike/teoria/rabota-v-termodinamike
- http://studopedia.ru/4_164895_maksimalnaya-i-maksimalno-poleznaya-rabota.html
- http://xn--i1abbnckbmcl9fb.xn--p1ai/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/314923/
- http://zna4enie.ru/opredelenie/rabota-v-termodinamike-opredelenie.html

